Chemiczny (?) Nobel 2014

 „Młody Technik”, publikując w listopadowym numerze artykuły o kontrowersjach wokół Nagrody Nobla, wykazał się nie lada zdolnością przewidywania (w czasie, gdy przygotowywano teksty, nie był jeszcze znany tegoroczny werdykt). Wyróżnienie z chemii wzbudziło bowiem ogromne zdziwienie wśród chemików – i nie tylko ich. Nie była zaskoczeniem nagroda przyznana kilku uczonym, bo obecnie wspólne badania prowadzą międzynarodowe zespoły z placówek położonych nawet w różnych częściach świata.
„Młody Technik”, publikując w listopadowym numerze artykuły o kontrowersjach wokół Nagrody Nobla, wykazał się nie lada zdolnością przewidywania (w czasie, gdy przygotowywano teksty, nie był jeszcze znany tegoroczny werdykt). Wyróżnienie z chemii wzbudziło bowiem ogromne zdziwienie wśród chemików – i nie tylko ich. Nie była zaskoczeniem nagroda przyznana kilku uczonym, bo obecnie wspólne badania prowadzą międzynarodowe zespoły z placówek położonych nawet w różnych częściach świata.
Nie dziwi też to, że „chemiczny” Nobel coraz rzadziej przyznawany jest za typowe prace z tej dziedziny i w ostatnich latach stał się raczej nagrodą „biochemiczną”. Do tego zdążono się już przyzwyczaić. Ale nagroda za mikroskop?! W zgodnej opinii wyróżnienie jest co prawda jak najbardziej zasłużone, lecz znacznie lepiej pasowałoby do Nobla z fizyki, gdyż mikroskop fluorescencyjny to urządzenie optyczne. Ewentualnie – medycyny, bo stosuje się je głównie do badań najdrobniejszych szczegółów budowy komórek.
Mikroskop optyczny i jego ograniczenia
W roku 1677 holenderski przyrodnik Antoni van Leeuwenhoek skonstruował pierwszy mikroskop, który mógł być stosowany w badaniach naukowych. Mikroskopy budowano wprawdzie już w końcu poprzedniego wieku, ale dopiero konstrukcja Leeuwenhoeka nadawała się do praktycznego wykorzystania. Przed oczami badaczy pojawił się świat, którego istnienia nie byli dotąd świadomi – uniwersum mikroskopijnych żyjątek i komórek budujących większe organizmy.
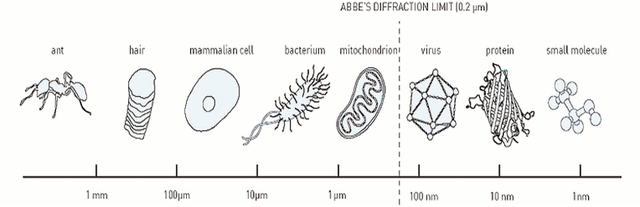
Wynalazek okazał się bardzo przydatny, zatem intensywnie pracowano nad jego rozwojem. W XIX wieku mikroskopy optyczne (badany obiekt oświetlało światło widzialne) były już prawie doskonałe, gdy zdano sobie sprawę z bariery, którą postawiły prawa przyrody. W roku 1873 niemiecki fizyk Ernst Abbe dowiódł, że można zobaczyć dwa punkty obrazu, jeśli ich odległość jest w przybliżeniu większa od połowy długości fali światła użytego do obserwacji. W przeciwnym razie zlewają się ze sobą. Ponieważ człowiek może jeszcze dostrzec światło fioletowe o długości fali 400 nm, oznacza to, że praktycznie nie jest możliwe rozróżnienie dwóch punktów odległych od siebie o mniej niż 200 nm (1 nm = 10–9 m). Wiele struktur komórkowych, nie mówiąc już o molekułach białek i kwasów nukleinowych, ma znacznie mniejsze rozmiary (4). Istnieją co prawda mikroskopy (elektronowe, sił atomowych) pozwalające uzyskać znacznie lepszą rozdzielczość (można dostrzec nawet zarysy pojedynczych atomów), ale nie nadają się one do obserwacji żyjących komórek i procesów, które w nich zachodzą.
wirus, cząsteczka białka, cząsteczka kilkuatomowa). Zaznaczono granicę rozdzielczości mikroskopu optycznego (1 μm = 1000 nm). (© Nobel Media AB)
Świecące molekuły
 Cząsteczki związków chemicznych pochłaniają promieniowanie elektromagnetyczne, a następnie emitują je do otoczenia. W niektórych przypadkach część energii jest rozpraszana w postaci ciepła, a reszta wypromieniowana w postaci światła o długości fali większej niż pochłaniane. Zjawisko to nazywane jest fluorescencją (od fluorytu CaF2, w którego kryształach zostało po raz pierwszy zaobserwowane). Niektóre ze związków obecnych w komórkach również fluoryzują (np. chlorofil), co zostało wykorzystane w konstrukcji mikroskopu fluorescencyjnego. Możliwe stało się więc dostrzeżenie niektórych składników komórek, słabo widocznych przy zwykłym oświetleniu.
Cząsteczki związków chemicznych pochłaniają promieniowanie elektromagnetyczne, a następnie emitują je do otoczenia. W niektórych przypadkach część energii jest rozpraszana w postaci ciepła, a reszta wypromieniowana w postaci światła o długości fali większej niż pochłaniane. Zjawisko to nazywane jest fluorescencją (od fluorytu CaF2, w którego kryształach zostało po raz pierwszy zaobserwowane). Niektóre ze związków obecnych w komórkach również fluoryzują (np. chlorofil), co zostało wykorzystane w konstrukcji mikroskopu fluorescencyjnego. Możliwe stało się więc dostrzeżenie niektórych składników komórek, słabo widocznych przy zwykłym oświetleniu.
W latach 60. XX wieku z organizmu pewnej meduzy wyizolowano tzw. białko zielonej fluorescencji (GFP – green fluorescent protein). Jest ono nietoksyczne i łatwo poddaje się chemicznym modyfikacjom. Wytworzono białka świecące w kilku kolorach i mogące przyłączać się do różnych molekuł. Dzięki tym osiągnięciom udało się otrzymać fluorescencyjne obrazy położenia badanych związków (innych białek, kwasów nukleinowych) w komórce. Jednak nadal obowiązywał „zakaz Abbe’go” – nie można było rozróżnić szczegółów mniejszych niż 200 nm.
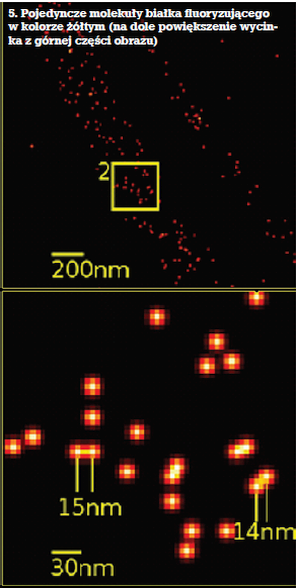
W roku 1989 William E. Moerner po raz pierwszy uzyskał obraz pojedynczej świecącej molekuły (cząsteczki były oddalone od siebie o więcej niż 200 nm). Co prawda w bardzo rozrzedzonych gazach zjawisko obserwowano już znacznie wcześniej, ale uczony dokonał tego w roztworze, czyli środowisku życia komórek (5). W roku 1997 Moerner, modyfikując GFP, otrzymał białko, które – gdy naświetlano je promieniowaniem o odpowiedniej długości fali – można było włączyć (wtedy fluoryzowało) lub wyłączyć (nie fluoryzowało).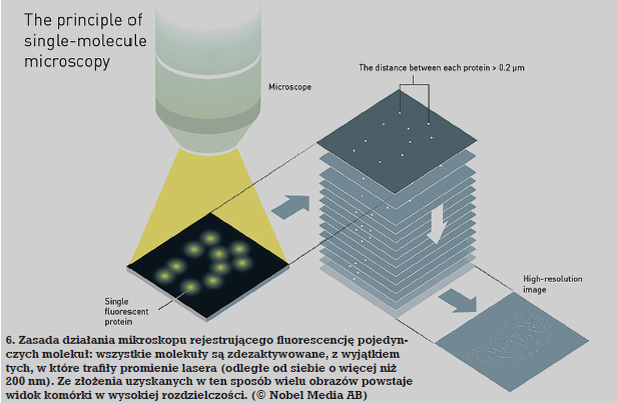
Nałożyć obrazy na siebie
Odkrycie Moernera rozwiązywało problem postawiony dwa lata wcześniej przez Erika Betziga. Zaproponował on, aby użyć molekuł świecących w różnych kolorach i rozproszonych w komórce w odległości większej niż 200 nm od siebie. Zmuszając cząsteczki do fluorescencji o określonej barwie, można by dokładnie określić ich położenie, a co za tym idzie, również lokalizację związanych z nimi fragmentów komórki. Pozwoliłoby to osiągnąć rozdzielczość lepszą niż graniczne 200 nm. Niestety, w owym czasie nie było jeszcze takich molekuł.
W roku 2006 Betzig wraz z zespołem skonstruował mikroskop fluorescencyjny, który nie używał cząsteczek świecących w różnych kolorach, lecz takich, które można było dowolnie włączyć i wyłączyć. Metoda jest następująca: komórkę z wprowadzonymi do wnętrza fluoryzującymi molekułami oświetla się tak dobranym promieniowaniem, aby wszystkie cząsteczki zostały zdezaktywowane. Następnie poddaje się ją pojedynczym pulsom laserowym, odległym od siebie o więcej niż 200 nm, które pobudzają molekuły do fluorescencji.
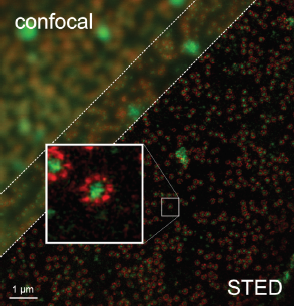
Potem znów następuje wyłączenie wszystkich cząsteczek i pobudzenie do świecenia innych niż poprzednio. W wyniku nałożenia wielu uzyskanych w ten sposób widm (oczywiście przy pomocy odpowiednio mocnego komputera) otrzymuje się obraz komórki, w którym można rozróżnić szczegóły odległe od siebie o zaledwie kilkanaście nm (6). Odmiany tej metody noszą nazwę: PALM (photo-activated localization microscopy – mikroskopia lokalizacji fotoaktywacyjnej), STORM (stochastic optical reconstruction microscopy – mikroskopia losowej rekonstrukcji obrazu) lub PAINT (points accumulation for imaging in nanoscale topography – gromadzenie punktów dla obrazowania topografii w nanoskali).
Zawęzić pole widzenia
W tym roku prace chemików nie znalazły uznania jury
nagrody (zdarzyło się to po raz trzeci w jej 24-letniej
już historii). Spośród docenionych osiągnięć pewien
chemiczny „posmak” (chyba jednak to określenie nie jest
na miejscu…) ma wyróżnienie w dziedzinie żywienia.
Hiszpańscy uczeni wydzielili z zawartości niemowlęcych
pieluch (!) bakterie kwasu mlekowego, których następnie
użyli do produkcji dojrzewających wędlin. Przypomnijmy,
że siedem lat wcześniej wyróżniono japońskich badaczy,
którzy otrzymali zapach waniliowy z krowich „placków”.
Być może nie warto zatem – w trosce o własny apetyt
– dociekać wszystkich kuchennych tajników...?
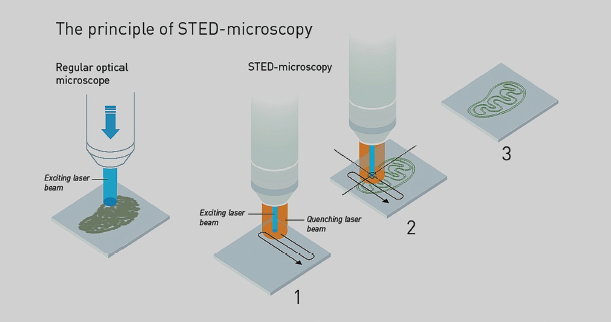
Również trzeci z noblistów, Stefan W. Hell, myślał o przełamaniu granicy 200 nm. Już w 1994 r. zaproponował następujące rozwiązanie: jednym pulsem lasera należy pobudzić do świecenia fluoryzujące molekuły znajdujące się w polu widzenia, a następnym (w kształcie obwarzanka) – zmusić do emisji promieniowania i w ten sposób wyłączyć wszystkie oprócz położonych w kole o średnicy ok. 20 nm. Obraz będzie zatem zawierał świecący punkt w centrum pola widzenia (albo nie, jeśli akurat nie było tam fluoryzującej molekuły). Następnie mikroskop przesuwany jest w kolejne miejsce komórki i cała procedura powtarza się.
Całością precyzyjnej mechaniki, pozwalającej bardzo dokładnie (od tego zależy wiarygodność uzyskanego obrazu) ustalić położenie aparatury, steruje system komputerowy. W ten sposób, skanując całą komórkę, otrzymuje się jej obraz w rozdzielczości dochodzącej do kilkunastu nm (7). Działający na tej zasadzie mikroskop fluorescencyjny został zbudowany przez Hella w roku 2000, a metoda nosi nazwę STED (stimulated emission depletion – wyłączenie przez wymuszoną emisję) (8).
I gdzie w tym wszystkim chemia?
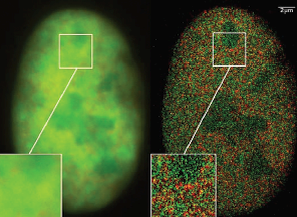
w zwykłym mikroskopie fluorescencyjnym, z prawej
– w mikroskopie PALM
No właśnie, gdzie? Spróbujmy znaleźć odpowiedź na to pytanie.
Po pierwsze: granice między klasycznymi dyscyplinami nauki już dawno się zatarły, a badacze największe sukcesy odnoszą właśnie na styku różnych dziedzin. Uczony badający żywe komórki musi być zatem i biologiem, i chemikiem, i fizykiem, nie zapominając przy tym o doskonałej znajomości obsługi sprzętu komputerowego i skomplikowanej aparatury badawczej.
Po drugie: nagrodzone metody mikroskopowe stwarzają ogromne pole do popisu dla chemików. Wraz z ich rozwojem potrzeba będzie nowych fluoryzujących molekuł, które w selektywny sposób będą się wiązały z wybranymi składnikami komórek (a ktoś musi przecież zsyntezować odpowiednie cząsteczki). Jeśli prace chemików się powiodą, można sobie wyobrazić znacznie lepszą diagnostykę różnych chorób oraz poszerzenie wiedzy o funkcjonowaniu naszych organizmów (9).
Po trzecie wreszcie: w przyszłym miesiącu zaprezentujemy w MT fluorescencję w domowym laboratorium.
promieniem lasera): 1) na próbkę pada promień lasera pobudzający molekuły do fluorescencji (niebieski)
oraz promień wygaszający ich świecenie (pomarańczowy) w obrębie pola widzenia (z wyjątkiem centrum);
2) mikroskop przesuwa się po powierzchni próbki; 3) otrzymujemy gotowy obraz w wysokiej rozdzielczości.
(© Nobel Media AB)