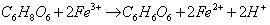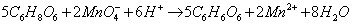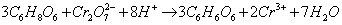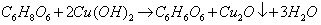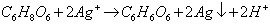Najpopularniejsza witamina - część 1
O witaminie C wiedziano już dawno, dawno temu, bo w starożytnym Egipcie - a właściwie o skutkach jej niedoboru, później nazwanego szkorbutem. Także pisma ojca medycyny, Hipokratesa, zawierają opis tej choroby: krwawienia, wypadanie zębów, osłabienie. Szkorbut zwany był chorobą więźniów i żeglarzy, często pozbawionych dostępu do produktów zawierających witaminę C.
W ciągu następnych stuleci choroba zbierała obfite żniwo, dziesiątkując załogi statków podczas długotrwałych morskich podróży. Zaobserwowano jednak, że dostęp do świeżych warzyw i owoców zapobiega szkorbutowi. Stopniowo wprowadzano je do diety marynarzy (zwłaszcza cytrusy, które można było dłużej przechowywać) i od XIX wieku nie notuje się już powszechnego występowania tej choroby (wyjątek stanowi czas wojen oraz uwięzienia w obozach koncentracyjnych i łagrach).
W początkach ubiegłego wieku poznano pierwsze witaminy (Kazimierz Funk, 1912) i zdano sobie sprawę z ich roli w prawidłowym funkcjonowaniu organizmu człowieka. W roku 1928 węgierski biochemik Albert Szent-Györgyi wyodrębnił z kory nadnerczy związek, który od sześciu atomów węgla w jego cząsteczce, nazwał kwasem heksuronowym. Niedługo potem przekonał się, że bogatym źródłem odkrytego związku jest również papryka (bądź co bądź „węgierskie” warzywo). Szent-Györgyi oraz amerykański biochemik Charles King w roku 1932 potwierdzili antyszkorbutowe działanie kwasu heksuronowego i zmienili jego nazwę na kwas askorbinowy (czyli przeciwdziałający szkorbutowi). Uwzględniając działanie biologiczne kwasu askorbinowego, nazwano go również witaminą C. Budowę związku ustalił angielski chemik Walter Haworth. Zarówno Szent-Györgyi, jak i Hawort zostali w roku 1937 wyróżnieni Nagrodami Nobla (odpowiednio z fizjologii i medycyny oraz z chemii).
W roku 1933 szwajcarski chemik polskiego pochodzenia, Tadeusz Reichstein, opracował metodę przemysłowej syntezy kwasu askorbinowego. Surowcem do produkcji jest glukoza, a w jednym z etapów „pracują” bakterie octowe. W czasach współczesnych procesy produkcyjne witaminy C nadal bazują na opracowanej przez Reichsteina technologii, ale coraz częściej wykorzystuje się genetycznie modyfikowane drobnoustroje.
Jak witaminę C widzi chemik…
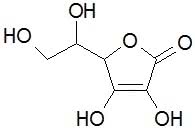
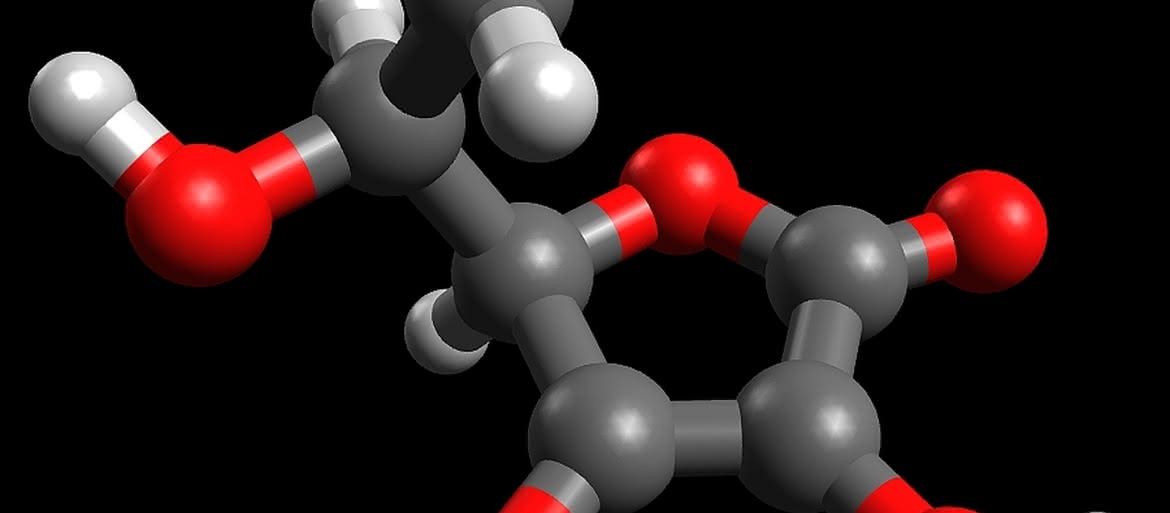
W pewnym uproszczeniu, bez uwzględniania przestrzennego położenia niektórych atomów, kwas askorbinowy ma następującą budowę cząsteczki (wzór jest zwykle stosowanym przedstawieniem molekuły związku organicznego, w miejscach łączenia wiązań znajdują się atomy węgla z odpowiednią liczbą atomów wodoru):
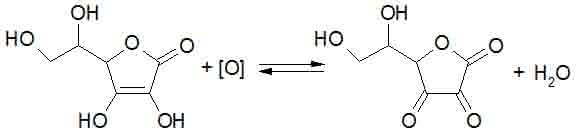
Choć we wzorze brak grupy karboksylowej, związek ma właściwości kwasowe (jest kwasem mocniejszym niż octowy!). Jedna z grup OH położona przy podwójnym wiązaniu dysocjuje (druga znacznie trudniej) i kwas askorbinowy tworzy sole. Podstawą aktywności biologicznej witaminy C jest łatwe odwracalne utlenianie do kwasu dehydroaskorbinowego (zapis [O] oznacza pojedynczy atom tlenu, a także związek mogący przyłączyć dwa atomy wodoru):
Kwas dehydroaskorbinowy może ulec dalszym przemianom prowadzącym do nieodwracalnego już otwarcia pierścienia, a następnie rozpadu cząsteczki.
… i fizjolog
Zapotrzebowanie na kwas askorbinowy znacznie przekracza normy ustalone dla innych witamin. Przyjmuje się, że na kilogram masy ciała człowiek powinien spożyć minimum 1 mg witaminy C dziennie (co dla dorosłych stanowi do 100 mg). Kwas askorbinowy musi być dostarczany z pożywieniem tylko w przypadku nielicznych gatunków zwierząt, większość sama potrafi go wytworzyć. W takiej samej sytuacji jak my znajdują się również inne naczelne, świnki morskie, a także niektóre nietoperze i ryby. Najbogatszym źródłem witaminy C w codziennej diecie są świeże owoce i warzywa (zawartość łatwo znaleźć samodzielnie). Mimo wielu lat badań nie poznano jeszcze wszystkich przemian metabolicznych, w których bierze udział ten związek. Najważniejsze z nich to:
- procesy utleniania i redukcji przebiegające wewnątrz komórek (za nie odpowiada przedstawiona wyżej reakcja);
- synteza hormonów w korze nadnerczy;
- synteza kolagenu, białka tkanki łącznej wchodzącego w skład m.in. ścięgien, chrząstek, skóry;
- usuwanie wolnych rodników działających niszcząco na DNA komórek;
- ułatwienie przyswajania żelaza.
Silny reduktor
Pora na eksperymenty, w których zobaczymy redukujące właściwości kwasu askorbinowego. Wspomniano o nich wyżej, nie wierzmy jednak na słowo. Przekonajmy się o wszystkim – jak na chemika przystało – doświadczalnie.
Do prób sporządzamy roztwór witaminy C. Usuwamy polewę z tabletki (zmywa się wodą) i rozcieramy ją w moździerzu lub drobno rozgniatamy łyżką (najlepiej drewnianą). Unikajmy kontaktu witaminy z metalowymi przedmiotami (za miesiąc o tym, dlaczego). Do proszku dodajemy niewielką ilość wody (kilkanaście cm3, kwas askorbinowy jest dobrze rozpuszczalny) i mieszamy zawartość naczynia. Najlepiej zrobić to bezpośrednio w moździerzu przy pomocy tłuczka. Otrzymanego roztworu można nie sączyć od nierozpuszczalnych pozostałości tabletki (substancje pomocnicze leku, np. stearynian magnezu czy dwutlenek krzemu). Jeśli chcemy mieć klarowny roztwór, powinniśmy szybko wykonać sączenie (powód również zostanie podany w przyszłym odcinku, choć po wykonaniu niżej przedstawionych prób będzie można się tego domyśleć). Roztwór daje się przechować przez krótki czas w szczelnie zamkniętym naczyniu w lodówce, ale lepiej sporządzać go w miarę potrzeby i od razy używać.
Zaczynamy. Oprócz roztworu witaminy C będą potrzebne kilkuprocentowe roztwory chlorku żelaza(III) FeCl3 i rodanku potasu KSCN. Do probówki z żółtawym roztworem FeCl3 wkraplamy roztwór witaminy C do całkowitego odbarwienia zawartości. Przebiegającą reakcję zapisujemy równaniem (wzory kwasów askorbinowego i dehydroaskorbinowego w postaci sumarycznej):
Czytelnik pewnie nie jest przekonany do podanego wyjaśnienia, w końcu niewiele się działo – tylko odbarwił się roztwór (jony Fe2+ są barwy bladozielonej, która w mniejszym stężeniu nie jest widoczna). Potrzebny jest mocniejszy dowód redukcji kationów żelaza(III).
Dodajmy zatem do probówki nieco roztworu KSCN, który tworzy z nimi kompleks o krwistoczerwonej barwie. Brak takiego koloru (zabarwienie powstaje nawet przy śladowej ilości jonów Fe3+) potwierdza zapisany wyżej przebieg reakcji. Jeśli nie mamy rodanku potasu, użyjmy roztworu wodorotlenku sodu NaOH.
W probówce powstanie wtedy brudnozielonkawe zabarwienie pochodzące od tworzącego się wodorotlenku żelaza(II) Fe(OH)2 (wodorotlenek żelaza(III) jest czerwonobrunatny) (3).

Dla jeszcze mocniejszego potwierdzenia przeprowadźmy reakcję kwasu askorbinowego z typowymi utleniaczami – nadmanganianem potasu KMnO4 i dichromianu(VI) potasu K2Cr2O7 (potrzebny będzie również roztwór kwasu siarkowego(VI) H2SO4). Do dwóch probówek nalewamy po kilka cm3 roztworów KMnO4 oraz K2Cr2O7 (o kilkuprocentowych stężeniach) i zakwaszamy je kilkoma kroplami roztworu H2SO4.
Teraz do każdego naczynia dodajemy roztwór witaminy C. Fioletowy roztwór KMnO4 błyskawicznie się odbarwia, a pomarańczowy roztwór K2Cr2O7 zmienia barwę na niebieskozieloną. W obu próbówkach witamina C zredukowała utleniacze (sama się oczywiście utleniając):
Jednak jeszcze przed ogrzaniem zwartości probówki można było dostrzec pojawienie się żółtawego zabarwienia spowodowanego utworzeniem niewielkich ilości Cu2O. Dowodzi to, że kwas askorbinowy – już na zimno reagując z Cu(OH)2 – jest silniejszym reduktorem niż glukoza.
Witamina C tak szybko redukuje azotan(V) srebra (po lewej roztwór przed reakcją, w środku zawiesina metalicznego srebra), że nie udaje się wykonać próby Tollensa (widoczne jedynie ślady lustra srebrowego – po prawej).
Z tego też powodu praktycznie niewykonalna jest próba Tollensa. Przygotujmy kilkuprocentowy roztwór azotanu(V) srebra AgNO3. Tym razem rozpuszczamy sól w wodzie destylowanej lub demineralizowanej (dostępna w sklepach z akcesoriami samochodowymi), aby uniknąć tworzenia zawiesiny chlorku srebra (jony chlorkowe są zawsze obecne w wodzie wodociągowej). Wlewamy roztwór do probówki i dodajemy po kropli roztwór kwasu askorbinowego (również przygotowany przy pomocy wody destylowanej). Od razu pojawia się ciemny osad metalicznego srebra (o dużym rozdrobnieniu):
To właśnie szybka redukcja jonów Ag+ (i tym razem już na zimno) uniemożliwi przeprowadzenie próby Tollensa. Czytelnicy mogą ją wykonać dla sprawdzenia słów autora, ale przekonają się, że lustro srebrowe nie powstanie lub pojawi się tylko w śladowej postaci. Nieznających szczegółów próby proszę o zapoznanie się z jej wymaganiami (do znalezienia w sieci) oraz przeprowadzenie jej najpierw dla glukozy (jako „trening”).
Tyle na temat redukujących właściwości kwasu askorbinowego. Za miesiąc o tym, czego należy unikać, aby nie narazić się na straty witaminy C w kuchni.
Czy zawsze pomaga?
Media pełne są informacji (często sprzecznych ze sobą) o cudownym działaniu rozmaitych środków leczniczych. Jedna z nich głosi, że podczas infekcji należy przyjmować duże ilości witaminy C. Przemysł farmaceutyczny oczywiście wychodzi naprzeciw oczekiwaniom pacjentów i półki aptek oraz drogerii pełne są medykamentów zawierających kwas askorbinowy. Tymczasem badania pokazują, że zażywanie witaminy C nie wpływa w istotny sposób na czas trwania przeziębienia. Stwierdzono jedynie, że profilaktyczne przyjmowanie jej preparatów u osób wykonujących ciężkie prace fizyczne w niskiej temperaturze pozwala zredukować ryzyko infekcji. Choć nadmiar kwasu askorbinowego jest szybko usuwany z moczem i trudno go przedawkować, to żaden lek nie powinien być stosowany na własną rękę. Niedobór witaminy C powoduje ciężkie schorzenia, jednak łykanie tabletek bez potrzeby nie zapewni nam „końskiego zdrowia” (a często wręcz przeciwnie). Naprawdę wystarczy dieta bogata w świeże owoce i warzywa.