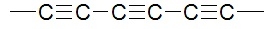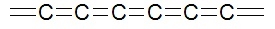Chemiczny gabinet osobliwości - część 3
Węgiel był znany od najdawniejszych czasów - najpierw w postaci niedopalonych kawałków drewna, potem jako kopalny minerał. Dopiero u progu XIX stulecia zdano sobie sprawę z tego, że jest on pierwiastkiem chemicznym.
Niezwykły pierwiastek
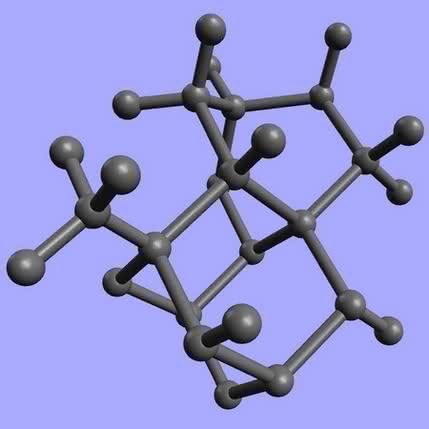
Jego dwie czyste postaci – diament i grafit – to substancje, których właściwości tak diametralnie się od siebie różnią, że nawet dzisiaj trudno wręcz uwierzyć, iż tworzą je atomy tego samego pierwiastka. Diament (z gr. adamas = niezwyciężony) to najtwardszy znany minerał, często przezroczysty, dobry izolator elektryczności. Grafit (z gr. graphein = pisać) – czarny, miękki, łatwo się ścierający, a w dodatku całkiem niezły przewodnik prądu. W XX wieku dowiedziono, że za tak różne właściwości odpowiada budowa wewnętrzna, czyli sposób połączenia atomów. Kryształ diamentu tworzy trójwymiarowa sieć, w której każdy z atomów połączony jest z czterema innymi. Wykorzystanie wszystkich dostępnych elektronów na wiązania powoduje dużą trwałość takiej konstrukcji oraz brak przewodnictwa elektrycznego (1). W graficie atomy węgla budują dość słabo związane płaszczyzny, które łatwo przesuwają się względem siebie (dzięki temu grafit sprawdza się w roli smaru). Każdy z atomów wykorzystuje tylko trzy z czterech dostępnych elektronów na wiązanie z sąsiadami, istnieją więc wolne nośniki ładunku, co zapewnia dobre przewodnictwo (2). Sadza, opisywana czasem jako kolejna odmiana węgla, jest bezpostaciową formą tego pierwiastka z domieszką grafitu.
Rzadkość występowania i wysoka cena diamentów sprawiły, że od dawna poszukiwano metod ich produkcji (nie mówiąc już o licznych fałszerstwach). W toku badań stwierdzono, że diamenty powstają w temperaturach znacznie przewyższających 1000ºC i pod ciśnieniem kilkadziesiąt tysięcy razy większym niż atmosferyczne. Takie warunki panują w górnej strefie płaszcza Ziemi i tylko bardzo rzadki zbieg zdarzeń jest je w stanie wynieść z głębokości kilkuset kilometrów na powierzchnię. Trudności techniczne sprawiły, że dopiero w II połowie ubiegłego wieku udało się otrzymać syntetyczne diamenty. Nie znajdują one uznania jubilerów, ale do zastosowań technicznych (cięcie twardych materiałów, tarcze ścierne, końcówki wierteł i świdrów) nadają się doskonale.
W wielu językach rozróżnia się węgiel jako pierwiastek chemiczny od węgla występującego naturalnie (kopalnego, drzewnego). Po polsku określamy je jednak taką samą nazwą, co pozostaje tylko sprawą specyfiki języka – np. u nas odrębne nazwy ma pierwiastek glin i metal techniczny, czyli aluminium.
Węglowe warstwy, …
Grafit, choć o mniej efektownym wyglądzie niż diament, ma jednak potencjał tworzenia nowych odmian węgla. Oczywiście każdemu od razu przyjdzie na myśl technologiczny hit ostatnich lat, czyli grafen (3). Pojedyncze, jednoatomowej grubości warstwy grafitu, z których składa się nowy materiał, wykazują cenne właściwości – dobre przewodnictwo cieplne i elektryczne, wytrzymałość mechaniczną znacznie przewyższającą osiągi stali lub kevlaru oraz ciekawe efekty kwantowe (w „Młodym Techniku” obszernie opisano grafen w numerze 5/2014). Bada się jego zastosowanie jako materiału mogącego zastąpić krzem w produkcji elementów elektronicznych, do wytwarzania elastycznych ekranów dotykowych, akumulatorów, ogniw fotowoltaicznych oraz w roli tworzywa konstrukcyjnego.
Pierwsze próbki grafenu otrzymano przez zwykłe odrywanie warstw grafitu przy pomocy taśmy klejącej. Jednak do tej pory nie ma ekonomicznej metody wytwarzania warstw o większej powierzchni (polscy naukowcy to światowa czołówka, jeśli chodzi o badania nad sposobami produkcji grafenu), a wysoka cena jest istotnym hamulcem rozwoju technologii.
Czy grafen spełni oczekiwania? Możliwości są ogromne, ale jak zawsze „diabeł tkwi w szczegółach”, czyli trudnościach technologicznych. Ponadto perypetie z innymi odmianami węgla (o nich w dalszej części artykułu) nakazują ostrożne prognozowanie. W każdym nowym materiale ludzkość upatruje panaceum na bolączki współczesnego świata (konieczność znalezienia tanich źródeł energii, leków i materiałów konstrukcyjnych) – a tymczasem częściej niż sukces przychodzi rozczarowanie. Jednak bez odpowiedniej dozy optymizmu nie warto nawet zaczynać badań. Odkrywców niech zaś prowadzą słowa Edisona, który na pytanie, czy nie zniechęcił się po kilku tysiącach nieudanych prób skonstruowania żarówki, odparł: „Nie poniosłem porażki. Po prostu odkryłem 10 tys. błędnych rozwiązań.”.
…klatki, …
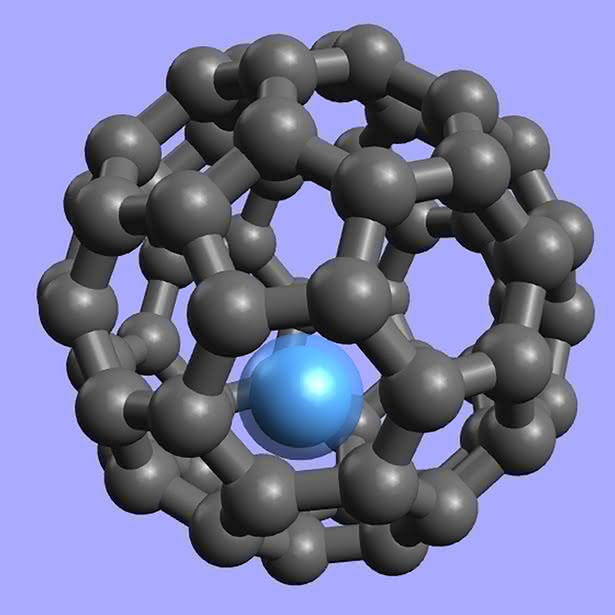
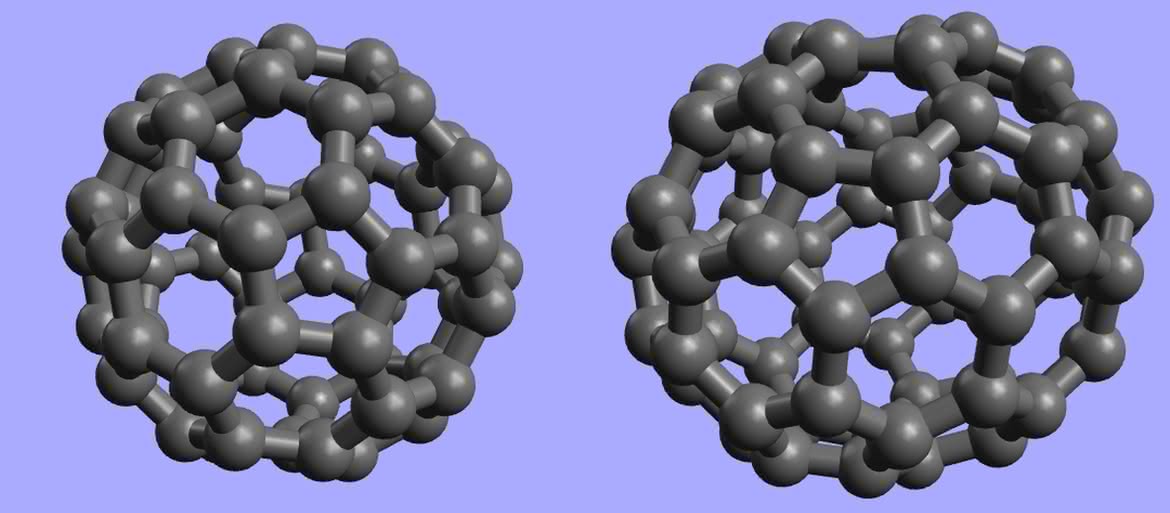
Pierwsze węglowe dziwactwa otrzymano w latach 80. ubiegłego stulecia. Podczas naświetlania tarczy grafitowej impulsami laserowymi powstawał cały szereg związków o nietypowej budowie, przypominającej klatki. Wśród nich przeważał układ złożony z 60 atomów węgla. W toku dalszych badań okazało się, że jest on podobny do powłoki piłki nożnej uszytej z 20 pięciokątów i 32 sześciokątów foremnych. Jednak zamiast nazwy „sportowej” nadano mu „architektoniczną” – buckminsterfulleren (od nazwiska Richarda Buckminster Fullera, amerykańskiego konstruktora kopuł). Odkryte później, podobne do C60 układy, określa się zbiorczym mianem fulerenów (4). Obecnie znamy już całą ich rodzinę. Są to kuliste i elipsoidalne twory, zawierające od 20 do ok. 1500 atomów węgla (zawsze parzystą liczbę).
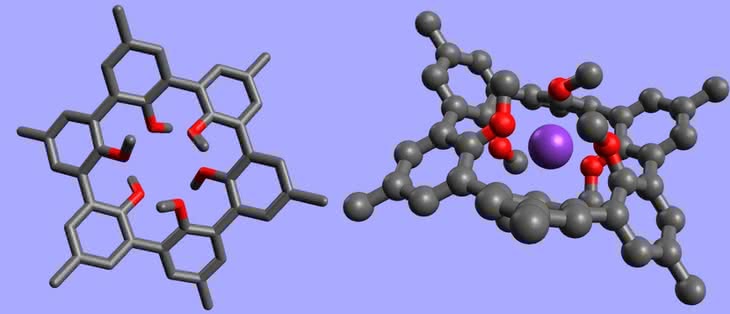
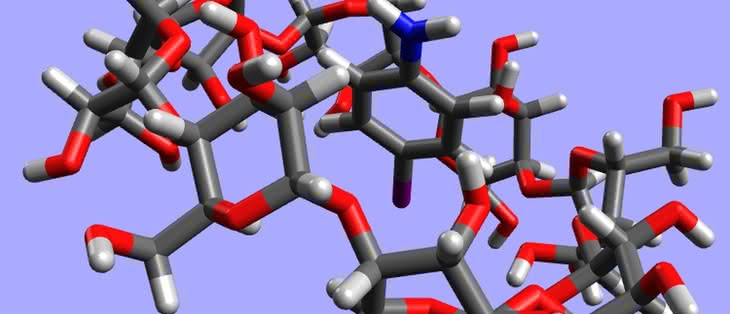
Fulereny są ciałami stałymi, o czarnej barwie i metalicznym połysku. Wykazują własności zbliżone do półprzewodników. Do ich powierzchni można przyłączać różne grupy atomów, co umożliwia użycie fulerenów w roli katalizatorów i przenośników (np. środków leczniczych). Wewnątrz fulerenów udało się zamknąć atomy innych pierwiastków (całość wygląda jak jajko z niespodzianką). Powstające układy mają oryginalne wzory, przypominające adresy mailowe, np. La@C60 (atom lantanu wewnątrz buckminsterfullerenu), a próbuje się je zastosować jako magnesy (5). Właściwości smarne fulerenów są zbliżone do grafitu i w tej roli również się je wykorzystuje.
Fulereny można uważać za fragmenty pojedynczych płaszczyzn grafitu zwiniętych w specyficzny sposób. Udało się otrzymać nawet węglowe cebulki, czyli fulereny o mniejszych rozmiarach, umieszczone wewnątrz większych (i to o kilku warstwach, co z kolei przypomina rosyjską matrioszkę).
Węglowe kulki są dość łatwo dostępne (światowa produkcja to kilkanaście ton rocznie) i stosunkowo niedrogie. Laboratoria badawcze nie narzekają więc na brak surowca. Jednak trzeba przyznać, że fulereny nie spowodowały jak dotąd rewolucji technologicznej. Ale może oczekiwania wobec nich były zbyt daleko idące?
…rurki i nitki.
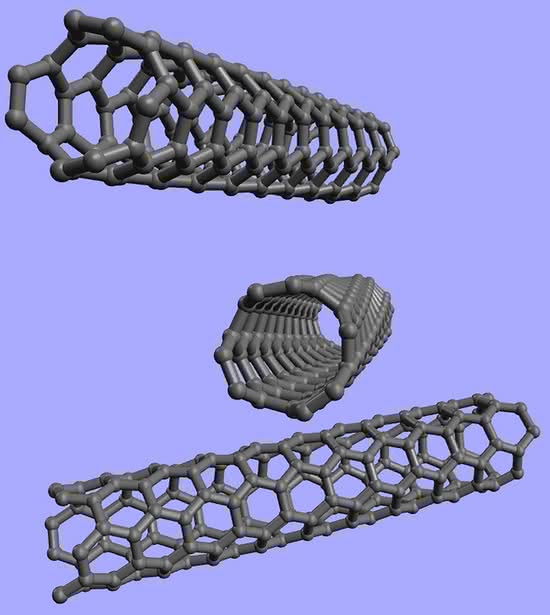
Końce pojedynczej warstwy grafitu mogą połączyć się, tworząc walec, czyli nanorurkę (to od średnicy tworu; nanometr jest milionową częścią milimetra). Końce świeżo otrzymanej węglowej rurki są zwykle zamknięte przez półkule, co upodabnia je do bardzo wydłużonego fulerenu. Jednak nie stanowi problemu otwarcie rurek, np. przez trawienie w kwasach (6). Metody otrzymywania nanorurek są podobne do sposobów produkcji fulerenów, czyli ogrzewania grafitu do wysokich temperatur (impulsy laserowe, łuk elektryczny). Wyprodukowano również rurki wielowarstwowe.
Węglowe rurki mogą być używane w roli podobnej do fulerenów i grafenu: katalizatory (po aktywowaniu powierzchni lub napełnieniu wnętrza – takie chemiczne „rurki z kremem”), surowce do budowy układów elektronicznych i elektrycznych (w zależności od sposobu przygotowania stają się przewodnikami lub półprzewodnikami) oraz tworzywa konstrukcyjne (są najbardziej wytrzymałymi na rozciąganie i najsztywniejszymi materiałami). Jednak większość zastosowań nadal znajduje się w fazie testów i badań, a znacznym ograniczeniem pozostaje niewielka wydajność produkcji.
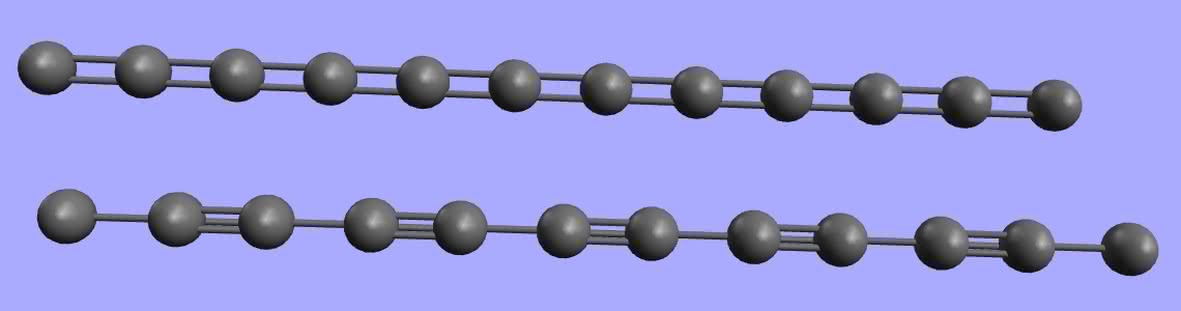
Od lat pojawiały się w prasie naukowej doniesienia o syntezie jeszcze jednej odmiany węgla – tym razem jednowymiarowej. Karbin, bo taką nazwę jej nadano, miał być układem atomów węgla połączonych naprzemiennymi wiązaniami pojedynczymi i potrójnymi (7):
lub też sąsiadującymi ze sobą podwójnymi:
Jednak trwałość takich molekuł jest niewielka – wiązania podwójne, a zwłaszcza potrójne, są reaktywne i wystarczą nawet ślady tlenu z powietrza, aby układ został zniszczony. Według wyliczeń karbin wykazuje ogromną wytrzymałość mechaniczną oraz możliwości magazynowania energii (rozrywania i ponowne tworzenie niektórych wiązań bez rozpadu całości). W roku 2016 udało się otrzymać węglową nitkę zamkniętą wewnątrz nanorurki, jednak ponownie przeszkodą na drodze dalszych badań jest śladowa wydajność syntezy.
Węgiel to bardzo interesujący pierwiastek, a potencjalnie nieograniczone możliwości łączenia się jego atomów stwarzają ciekawe perspektywy przed inżynierią materiałową, czyli technologią, od której postępów będzie zależał rozwój cywilizacji w XXI wieku. Na zakończenie zaś, dla Czytelników, którzy dotarli do końca artykułu:
Domowa metoda produkcji fulerenów!
Niestety, nie rzeczywistych cząsteczek, ale modeli, który pozwolą obejrzeć ze wszystkich stron ich molekuły. Wystarczy kartka papieru, ołówek, nożyczki i klej. Oto poszczególne etapy postępowania:
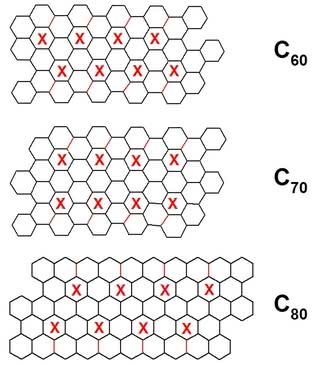
- Narysuj na kartce sieć sześciokątów wg załączonych do artykułu szkiców (8). Jak? Najłatwiej przy pomocy programu graficznego (może być nawet moduł graficzny edytora tekstu) lub też metodą szkolną, znaną z lekcji matematyki (podział obwodu koła jego promieniem pozwoli narysować sześciokąt foremny, a potem wystarczy wyciąć figurę i użyć ją jako szablon).
- Wytnij siatkę modelu i poprzecinaj ją wzdłuż zaznaczonych na czerwono linii. Do wycięcia są przeznaczone również sześciokąty ze znakiem X.
- Sześciokąty leżące po obu stronach przeciętej linii nałóż na siebie i przyklej (musisz nieco nagiąć sąsiadujące części siatki). W ten sposób otrzymasz pusty w środku pięciokąt otoczony sześciokątami. Postępuj w ten sam sposób z kolejnymi fragmentami modelu. Gdy będziesz wyginał fragmenty zawsze w tę samą stronę, zobaczysz, że zaczną się układać w kulistą strukturę. Po sklejeniu ostatniego kawałka możesz już obejrzeć model fulerenu. Wykonaj wszystkie modele (inne siatki są do znalezienia w Internecie), aby porównać cząsteczki ze sobą (9).