Roztwarzanie metali

Pierwsze doświadczenie umożliwi zaobserwowanie przemian zachodzących podczas działania na metaliczny glin kwasem solnym HCl oraz zasadą sodową NaOH (fotografia 1). Po napełnieniu probówek roztworami wrzucamy do nich kawałki oczyszczonego drutu aluminiowego. W obu probówkach na powierzchni metalu wydzielają się pęcherzyki gazu (fotografia 2). Jest to wodór powstający w reakcjach:
2Al + 6HCl → 2AlCl3 + 3H2
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
W reakcji glinu z kwasem solnym tworzy się chlorek glinu, zaś z wodorotlenkiem sodu związek kompleksowy o nazwie tetrahydroksoglinian sodu. Glin jest metalem o własnościach amfoterycznych, reagującym zarówno z kwasami, jak i zasadami.
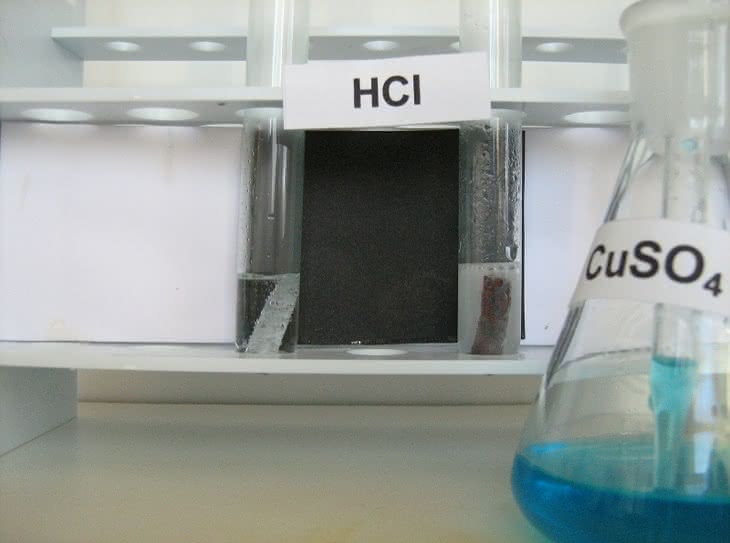
W kolejnej próbie roztworzymy metaliczny cynk w kwasie solnym HCl (fotografia 3). Do dwóch probówek nalewamy nieco roztworu HCl i wrzucamy do nich oczyszczone blaszki cynkowe. Na powierzchni metalu powoli wydzielają się pęcherzyki gazu (fotografia 4):
Zn + 2HCl → ZnCl2 + H2
Wydzielanie wodoru na powierzchni czystego cynku zachodzi bardzo opornie. Po dodaniu do jednej z probówek kilku kropli roztworu siarczanu(VI) miedzi(II) CuSO4 (fotografia 5) szybkość wydzielania wodoru wzrasta. Zjawisko spowodowane jest osadzaniem na powierzchni cynku metalicznej miedzi (cynk jako metal aktywniejszy wypiera miedź z roztworu jej soli), czego dowodzi wyraźne ciemnienie blaszki cynkowej (fotografia 6 i 7). Tworzą się lokalne ogniwa galwaniczne, co ułatwia przechodzenie cynku do roztworu, zaś wodór wydziela się na osadzonej miedzi.
W trzecim eksperymencie sprawdzimy zachowanie metalicznej miedzi wobec kwasu solnego HCl i azotowego(V) HNO3 (fotografia 8). Do dwóch probówek zawierających roztwory kwasów wrzucamy kawałki drutu miedzianego (uprzednio starannie oczyszczonego z nalotu). Podczas gdy w probówce z roztworem kwasu solnego brak oznak zachodzenia reakcji, w probówce z roztworem kwasu azotowego(V) rozpoczyna się intensywne wydzielanie gazu, zaś zawartość przybiera niebieskie zabarwienie (fotografia 9). Nad powierzchnią roztworu gromadzą się gazy o brunatnej barwie (fotografia 10).
Miedź należy do metali półszlachetnych, co oznacza, że nie reaguje z kwasami z wydzieleniem wodoru (brak oznak reakcji z HCl). Ulega natomiast działaniu kwasów utleniających (reakcja z HNO3); wodór nie wydziela się jednak i w tym wypadku. Proces prowadzi do wytworzenia mieszaniny produktów:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Powstające tlenki azotu reagują z tlenem oraz dimeryzują (dwie cząsteczki łączą się ze sobą), tworząc mieszaninę gazów o brunatnym zabarwieniu. Za niebieski kolor roztworu odpowiedzialne są uwodnione jony miedzi(II).