Krok w stronę nanotechnologii

Jedno z doświadczeń o historycznym znaczeniu, które umożliwiło obliczenie rozmiarów cząsteczek, przeprowadził angielski uczony lord Rayleigh. Ponieważ jest łatwe do wykonania i zarazem bardzo przekonujące, więc spróbujemy je powtórzyć w warunkach domowych. Następnie zajmiemy się dwoma innymi doświadczenia, które pozwolą nam poznać niektóre właściwości cząsteczek.
Jakie są rozmiary cząsteczek?
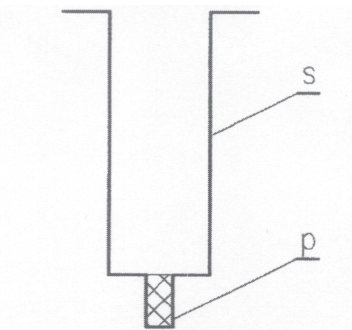
s – strzykawka
Spróbujemy odpowiedzieć na to pytanie, wykonując następujące doświadczenie. Ze strzykawki o pojemności 2 cm3 wyjmujemy tłoczek, a jej wylot zaklejamy Poxiliną, tak żeby wypełniła całkowicie rurkę wylotową, przeznaczoną do nakładania igły (rys. 1). Czekamy kilkanaście minut, aż Poxilina stwardnieje. Gdy to się stanie, do strzykawki wlewamy ok. 0,2 cm3 oleju jadalnego i zapisujemy tę wartość. Jest to objętość użytego oleju Vo. Pozostałą objętość strzykawki napełniamy benzyną ekstrakcyjną. Obie ciecze mieszamy drucikiem, aż do uzyskania jednorodnego roztworu i mocujemy strzykawkę pionowo w dowolnym uchwycie.
Następnie, do miednicy nalewamy ciepłej wody – tak, by jej głębokość wynosiła 0,5-1 cm. Należy użyć wody ciepłej, ale nie gorącej, żeby nie było widać unoszącej się pary. Po powierzchni wody kilkakrotnie przeciągamy przyłożonym do niej stycznie paskiem papieru w celu oczyszczenia powierzchni z przypadkowych pyłków.
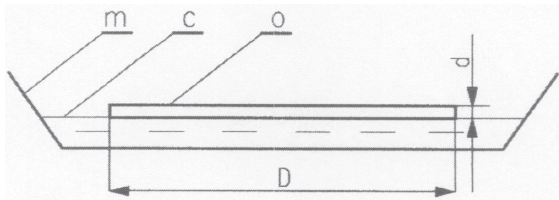
Do zakraplacza wciągamy nieco mieszaniny oleju z benzyną i przenosimy zakraplacz nad środek naczynia z wodą. Ostrożnie naciskając gumkę, upuszczamy możliwie małą kropelkę na powierzchnię wody. Kropelka mieszaniny oleju z benzyną rozpłynie się szeroko we wszystkich kierunkach po powierzchni wody i utworzy bardzo cienką warstewkę o grubości równej w najkorzystniejszych warunkach jednej średnicy cząsteczek – tzw. warstwę monomolekularną. Po pewnym czasie, wynoszącym zwykle kilka minut, benzyna odparuje (co przyspiesza podwyższona temperatura wody) i na powierzchni pozostanie monomolekularna warstwa oleju (rys. 2). Wytworzona warstwa ma najczęściej kształt zbliżony do koła o średnicy kilkunastu centymetrów lub większej.
(rozmiary cząsteczek oleju)
Powierzchnię wody oświetlamy, kierując na nią ukośnie wiązkę światła z latarki. Dzięki temu lepiej uwidaczniają się granice warstwy. Możemy łatwo odczytać jej przybliżoną średnicę D na linijce trzymanej tuż nad powierzchnią wody. Znając tę średnicę, możemy obliczyć powierzchnię warstwy S ze wzoru na powierzchnię koła: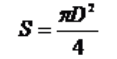
Gdybyśmy wiedzieli, jaka jest objętość oleju V1 zawartego w upuszczonej kropelce, wówczas średnicę cząsteczki oleju d moglibyśmy łatwo obliczyć, zakładając, że olej rozpłynął się, tworząc warstwę o powierzchni S, czyli: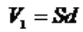
Po porównaniu wzorów (1) i (2) oraz prostym przekształceniu otrzymujemy wzór pozwalający obliczyć rozmiary cząsteczki oleju: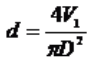
Najprostszym, choć nie najdokładniejszym sposobem wyznaczenia objętości V1 jest sprawdzenie, ile kropelek N daje się uzyskać z całej objętości mieszaniny zawartej w strzykawce i podzielenie objętości użytego oleju Vo przez tę liczbę. W tym celu do zakraplacza nabieramy mieszaniny i wytwarzamy kropelki, starając się, żeby miały podobną wielkość, jak podczas upuszczania na powierzchnię wody. Postępujemy w ten sposób aż do wyczerpania całej mieszaniny.
Dokładniejszy, ale bardziej pracochłonny sposób polega na tym, że wielokrotnie przeprowadza się upuszczanie kropelki oleju na powierzchnię wody, oraz wytwarzanie monomolekularnej warstwy oleju i pomiar jej średnicy. Oczywiście przed każdym wytworzeniem warstwy trzeba wylać z miednicy poprzednio użytą wodę z olejem i nalać czystej. Z otrzymanych pomiarów oblicza się średnią arytmetyczną wartość D.
Podstawiając uzyskane wartości do wzoru (3), należy pamiętać o przeliczeniu jednostek i wyrażeniu D w metrach (m) oraz V1 w metrach sześciennych (m3). Otrzymamy rozmiar cząsteczek d w metrach. Rozmiar ten będzie zależał od rodzaju użytego oleju. Wynik może być obciążony błędem, ze względu na przyjęte założenia upraszczające, a w szczególności na fakt, że warstwa nie była monomolekularna oraz że rozmiary kropelek też nie zawsze były jednakowe. Łatwo zauważyć, że brak monomolekularności warstwy prowadzi do zawyżonej wartości d. Typowe rozmiary cząsteczek oleju znajdują się w granicach 10-8-10-9 m. Jednostka równa 10-9 m jest nazywana nanometrem i często używana w intensywnie rozwijającej się dziedzinie określanej jako nanotechnologia.
„Znikająca” objętość cieczy
t – przezroczysta taśma klejąca
Następne dwa doświadczenia pozwolą nam stwierdzić, że cząsteczki różnych ciał mają różne kształty i rozmiary. Żeby przeprowadzić pierwsze z nich, odcinamy dwa kawałki przezroczystego, plastikowego wężyka, oba o średnicy wewnętrznej 1-2 cm i długości 30 cm. Każdy odcinek wężyka przyklejamy kilkoma kawałkami taśmy klejącej do brzegu oddzielnej linijki, naprzeciw podziałki (rys. 3). Dolne końce wężyków zamykamy korkami zrobionymi z Poxiliny. Obie linijki z przyklejonymi wężykami mocujemy w pozycji pionowej. Do jednego z wężyków nalewamy tyle wody, żeby uzyskać słupek o wysokości sięgającej w przybliżeniu do połowy długości wężyka, np. 14 cm. Do drugiego wężyka nalewamy taką samą ilość alkoholu etylowego.
Stawiamy teraz pytanie, jaka będzie wysokość słupka mieszaniny obu cieczy? Spróbujemy uzyskać na nie odpowiedź na drodze doświadczalnej. Przelewamy alkohol do wężyka z wodą i zaraz po tym odczytujemy, na jakiej wysokości znajduje się górny poziom cieczy. Zaznaczamy ten poziom wodoodpornym cienkopisem na wężyku. Następnie mieszamy obie ciecze drucikiem i ponownie odczytujemy poziom. Co zauważamy? Okazuje się, że poziom ten uległ obniżeniu, czyli objętość mieszaniny jest mniejsza niż suma objętości składników użytych do jej wytworzenia. Zjawisko to nazywa się kontrakcją objętości cieczy. Zmniejszenie objętości wynosi zwykle kilka procent.
Modelowe wyjaśnienie
Żeby wyjaśnić efekt kontrakcji, wykonamy doświadczenie modelowe. Cząsteczki alkoholu będą w tym doświadczeniu reprezentowane przez ziarna grochu, a cząsteczki wody przez ziarenka maku. Do pierwszego, wąskiego, przezroczystego naczynia, np. wysokiego słoika, wsypujemy groch o dużych ziarnach do ok. 0,4 wysokości. Do drugiego, identycznego naczynia wsypujemy do tej samej wysokości ziarenka maku (fot. 1a). Następnie przesypujemy mak do naczynia z grochem i mierzymy linijką wysokość, do której sięga górny poziom ziarenek. Zaznaczamy ten poziom cienkopisem lub gumką aptekarską na naczyniu (fot. 1b). Zamykamy naczynie i wielokrotnie nim potrząsamy. Ustawiamy je pionowo i sprawdzamy, do jakiej wysokości sięga teraz górny poziom mieszaniny ziaren. Okazuje się, że jest on niższy niż przed zmieszaniem (fot. 1c).
Z przeprowadzonego doświadczenia wynika, że po zmieszaniu drobne ziarenka maku wypełniły wolne przestrzenie między ziarnami grochu i skutkiem tego całkowita objętość zajmowana przez mieszaninę uległa zmniejszeniu. Podobna sytuacja występuje w przypadku mieszania wody z alkoholem i niektórych innych cieczy. Ich cząsteczki mają różne wielkości i kształty. Na skutek tego cząsteczki o mniejszych rozmiarach wypełniają przestrzenie między większymi cząsteczkami i zachodzi kontrakcja objętości cieczy.
b) ziarna po zsypaniu, c) zmniejszenie objętości ziaren po wymieszaniu
Współczesne konsekwencje
Dziś powszechnie wiadomo, że wszystkie otaczające nas ciała zbudowane są z cząsteczek, a te z kolei składają się z atomów. Zarówno cząsteczki jak i atomy są w ciągłym nieuporządkowanym ruchu, którego szybkość zależy od temperatury. Dzięki współczesnym mikroskopom – zwłaszcza skaningowemu mikroskopowi tunelowemu (STM – scanning tunneling microscope) – można oglądać pojedyncze atomy. Znane są też metody, wykorzystujące mikroskop sił atomowych (AFM – atomic force microscope), pozwalające na precyzyjne przemieszczanie pojedynczych atomów i budowanie z nich układów nazywanych nanostrukturami. Efekt kontrakcji też ma praktyczne znaczenie. Musimy go uwzględniać, dobierając ilość niektórych cieczy, potrzebną do otrzymania mieszaniny o wymaganej objętości. Trzeba się z nim liczyć, m.in. przy produkcji wódek, które jak wiadomo są mieszaninami głównie alkoholu etylowego (spirytusu) i wody, ponieważ objętość uzyskanego napoju będzie mniejsza od sumy objętości składników.