Związki kompleksowe kobaltu

Chlorek kobaltu(II) od dawna jest stosowany jako atrament sympatyczny, służący do ukrywania wiadomości. Do wykonania próby sporządzamy rozcieńczony 1-2% wodny roztwór CoCl2 (fotografia 1). Za jego pomocą piszemy na kartce papieru dowolny tekst (fotografia 2). Po wyschnięciu litery są praktycznie niewidoczne, bladoróżowe (fotografia 3).
Ostrożne podgrzanie kartki (fotografie 4, 5) pozwala ujawnić ukryte znaki (Co - symbol kobaltu), które stają się niebieskie (fotografia 6). Po umieszczeniu kartki nad szklanką z parującą wodą (fotografia 7) litery ponownie znikają (fotografia 8). Za zmiany barwy odpowiedzialny jest stopień uwodnienia chlorku kobaltu(II). Po napisaniu wiadomości związek występuje w postaci heksahydratu CoCl2·6H2O o bladoróżowej barwie. Ogrzanie powyżej temperatury 35°C powoduje stopniową utratę wody krystalizacyjnej i w efekcie powstanie bezwodnej soli o ciemnoniebieskim zabarwieniu:
Ochłodzenie i umieszczenie w wilgotnym środowisku umożliwia wiązanie pary wodnej przez higroskopijną sól bezwodną, co skutkuje zmianą zabarwienia na bladoróżowe (przebiega reakcja odwrotna do powyższej)
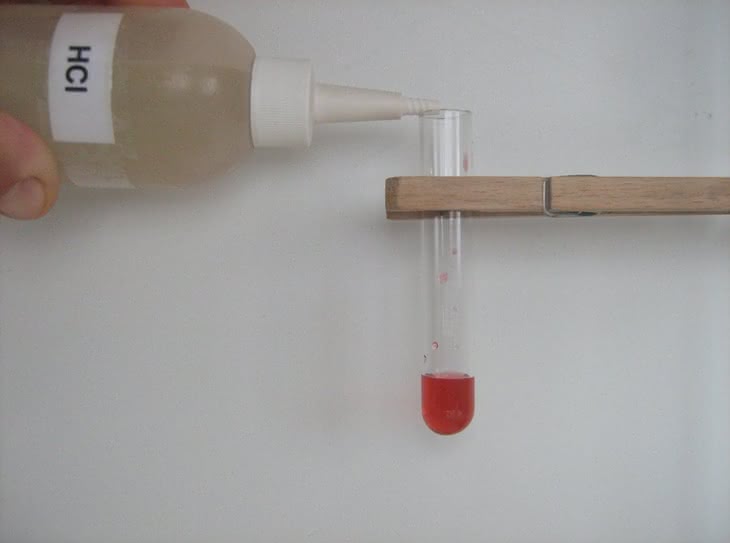
Odwodnienie akwakompleksu kobaltu(II) można osiągnąć nie tylko poprzez wzrost temperatury, lecz także działaniem niektórych substancji o własnościach higroskopijnych. Do przeprowadzenia następnej próby potrzebny będzie stężony roztwór chlorku kobaltu(II) CoCl2 oraz stężony kwas solny (fotografia 9).
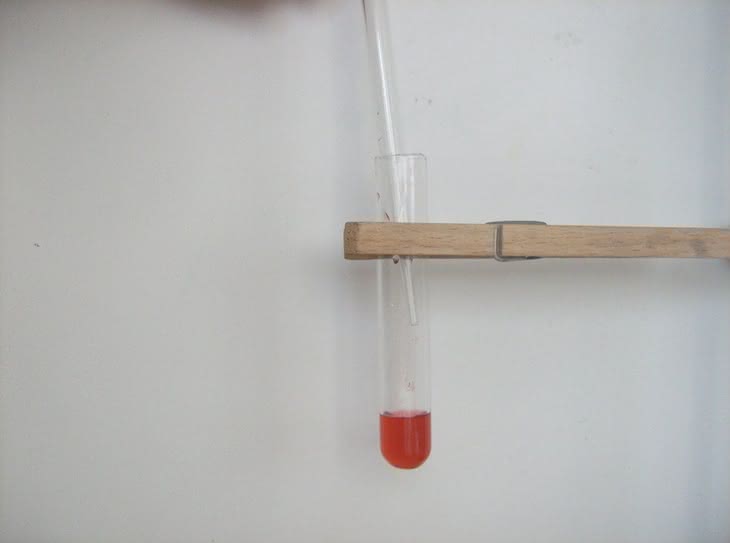
Do probówki nalewamy niewielką objętość ciemnoróżowego roztworu soli kobaltu, a następnie dodajemy kwas solny (fotografia 10). Zawartość naczynia zmienia barwę na fioletowoniebieską. Zjawisko spowodowane jest "wyciąganiem" cząsteczek wody ze sfery koordynacyjnej jonu kobaltu(II) przez silnie higroskopijną substancję. Ich miejsce zajmują jony chlorkowe obecne w roztworze:
Fotografia 11 przedstawia oba kompleksy: z lewej strony - ciemnoróżowy akwakompleks, z prawej - fioletowoniebieski kompleks chlorkowy.
Przeprowadzimy jeszcze jedną próbę otrzymania odwodnionego kompleksu kobaltu(II). Do jej wykonania potrzebny będzie aceton oraz krystaliczny sześciowodny chlorek kobaltu(II) CoCl2·6H2O (fotografia 12). Do probówki nasypujemy niewielką ilość ciemnoróżowych kryształów i dodajemy niewielką ilość acetonu (fotografia 13). Ciecz nad resztkami nierozpuszczonej soli przybiera niebieskie zabarwienie (fotografia 14), pochodzące od kompleksów kobaltu(II), które utraciły część cząsteczek wody, pierwotnie w nich zawartych. Bezwodny aceton jest substancją silnie higroskopijną.
Związek kompleksowy kobaltu(III) jest czułym odczynnikiem, pozwalającym wykryć jony potasu K+. Ta własność jest bardzo cenna, ponieważ praktycznie wszystkie związki potasu są dość dobrze rozpuszczalne w wodzie (klasyczna analiza chemiczna opiera się w znacznej mierze na tworzeniu osadów). Przygotujmy zatem niezbędne odczynniki: roztwór chlorku kobaltu(II) CoCl2, kwasu octowego CH3COOH oraz azotanu(III) potasu KNO2 (fotografia 15).
Próbę rozpoczynamy od nalania do probówki niewielkiej ilości roztworu CoCl2 o różowej barwie. Następnie dodajemy nieco roztworu kwasu octowego, a potem azotanu(III) potasu (fotografia 16). Zawartość naczynia stopniowo zmienia barwę na żółtopomarańczową (fotografie 17, 18, 19) pochodzącą od tworzącego się osadu:
Podczas reakcji nastąpiło utlenienie jonu kobaltu(II) przez jony azotanowe(III). Dopiero kompleksowe połączenie kobaltu(III) z potasem jest trudno rozpuszczalne i dzięki temu umożliwia potwierdzenie obecności kationów K+ w badanym roztworze.