Analiza kroplowa
W poniższych doświadczeniach zastosujemy poszczególne rodzaje tej metody.
Pierwsza próba będzie polegała na przeprowadzeniu reakcji na płytce. W laboratoriach stosowane są specjalne płytki porcelanowe z wgłębieniami, w których miesza się ze sobą krople roztworu badanego i odczynnika. Do naszych celów wystarczający będzie blister po tabletkach (fot. 1).
Przygotujmy jeszcze roztwory:
– kationów metali: Ag+ (do próby używamy np. AgNO3), Hg2+ (np. Hg(NO3)2), Pb2+ (np. Pb(NO3)2) i Bi3+ (np. Bi(NO3)3);
– oraz anionów: OH– (np. NaOH), I– (np. KI) i (np. K2CrO4).
Do kolejnych wgłębień po tabletkach wprowadzamy po kilka kropli roztworów kationów (fot. 2), a następnie anionów (fot. 3). We wszystkich przypadkach obserwujemy wytrącanie barwnych osadów (fot. 4). Osady o ciemnych barwach lepiej widoczne są na jasnym tle (fot. 5), a te o jasnym zabarwieniu – na ciemnym (fot. 6).
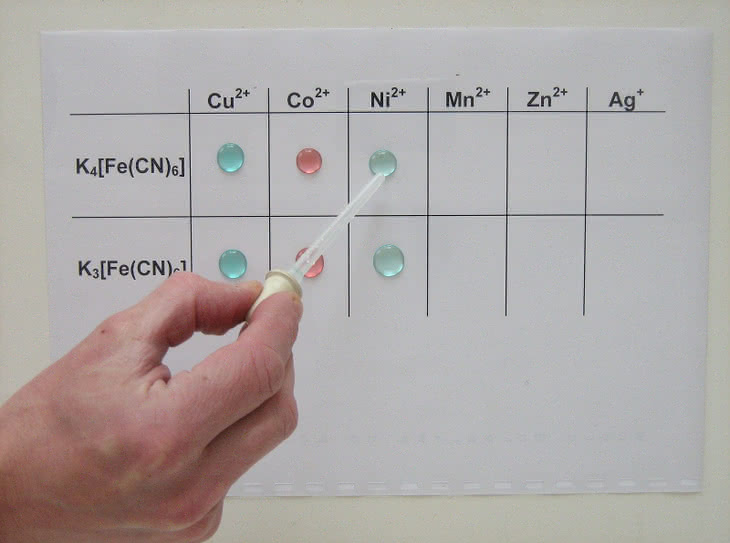
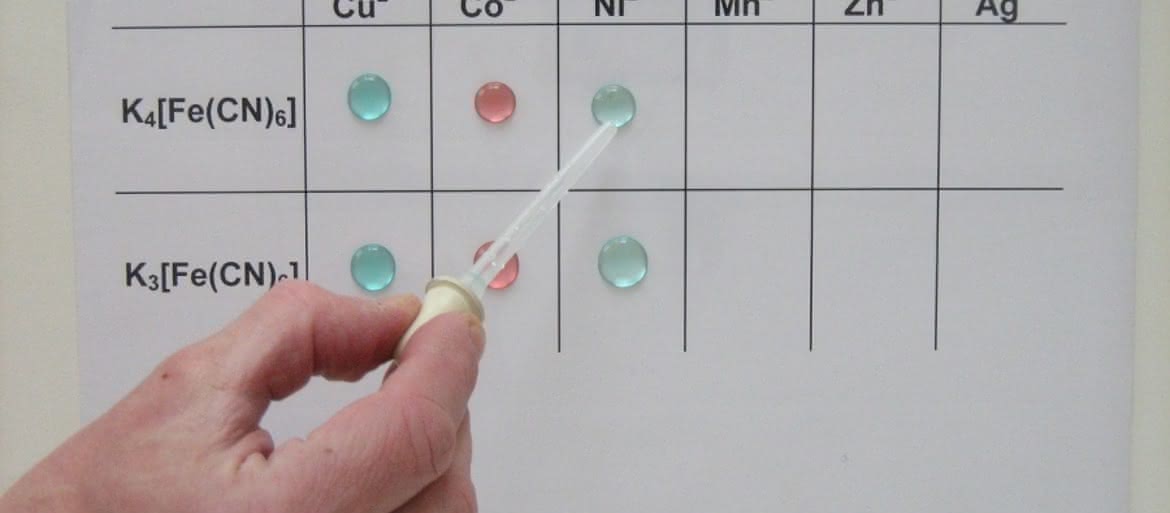
Drugi eksperyment wykonamy na folii, pod którą podłożymy kartkę papieru z oznaczeniami użytych w reakcjach jonów. Tym razem otrzymamy osady heksacyjanożelazianów.
Potrzebne odczynniki to:
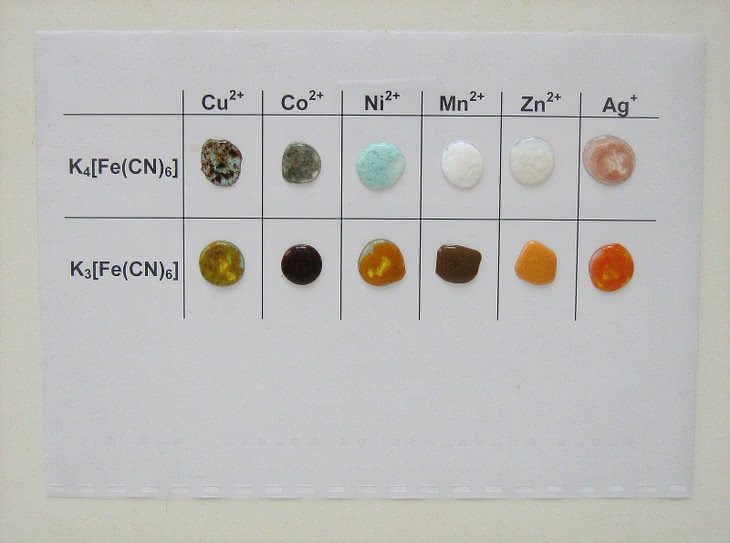
– heksacyjanożelazian(II) potasu K4[Fe(CN)6] zwany żelazocyjankiem potasu (tworzy żółte kryształy uwodnionej soli);
– heksacyjanożelazian(III) potasu K3[Fe(CN)6] zwany żelazicyjankiem potasu (tworzy czerwone kryształy);
– roztwory kationów metali: Cu2+ (np. CuSO4), Co2+ (np. CoCl2), Ni2+ (np. NiCl2), Mn2+ (np. MnSO4), Zn2+ (np. ZnSO4) i Ag+ (np. AgNO3).
Na folię nanosimy roztwory kationów (fot. 7), a następnie heksacyjanożelazianów (fot. 8). Podobnie jak w pierwszej próbie obserwujemy wytrącanie barwnych osadów (fot. 9).
W kolejnym doświadczeniu wykryjemy jony znajdujące się w mieszaninie. W tym celu użyjemy bibuły filtracyjnej oraz wzorcowych roztworów zawierających szukane jony. Rozpoczniemy od identyfikacji kationów Cu2+ (np. CuSO4) i Fe3+ (np. FeCl3) za pomocą wody amoniakalnej NH3aq.
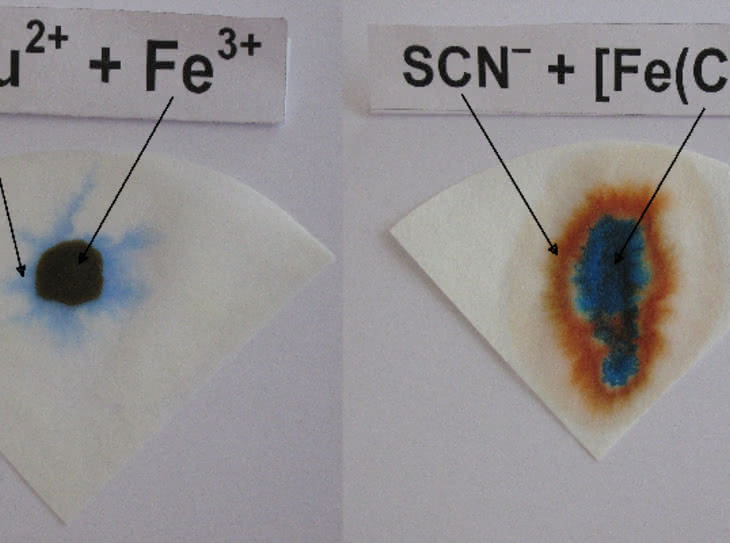
Na fragment bibuły filtracyjnej nanosimy roztwór amoniaku (fot. 10), a następnie roztwór soli danego metalu. W obu przypadkach otrzymujemy barwne plamy: niebieską dla jonów Cu2+ i brunatną dla Fe3+ (fot. 11). Następnie powtarzamy procedurę, używając mieszaniny kationów. W tym przypadku obserwujemy plamę dwubarwną: w środku znajduje się ciemny obszar, na zewnątrz – niebieski (fot. 12).
Porównując wyniki z próbkami wzorcowymi, wnioskujemy: w mieszaninie obecne są jony żelaza(III) (ciemne zabarwienie w środku) oraz miedzi(II) (błękitna otoczka). Gdybyśmy wykonali taki eksperyment w probówce, ciemny osad związku żelaza przysłoniłby barwę połączenia miedzi. Dzięki siłom kapilarnym rozprowadzającym ciecz po powierzchni bibuły można zidentyfikować oba kationy równocześnie (ich związki „wędrują” z różną szybkością).
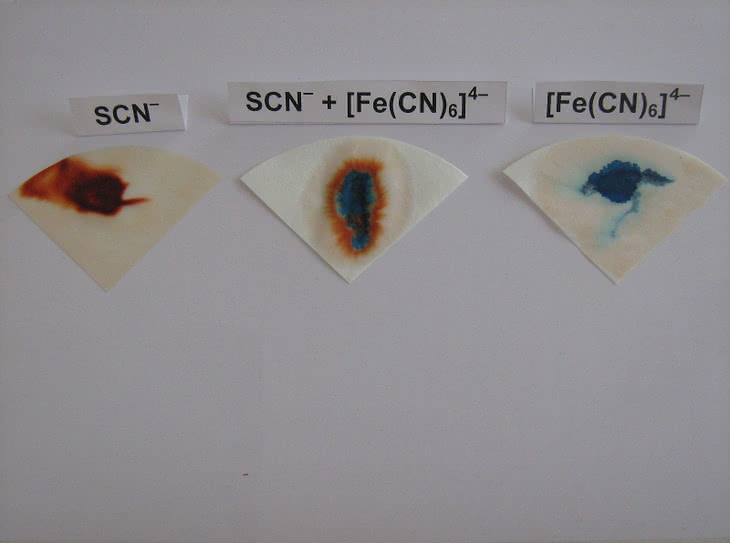
W dalszej części eksperymentu wykryjemy anion rodankowy SCN– (np. KSCN) obok żelazocyjankowego [Fe(CN)6]4– (np. K4[Fe(CN)6]) za pomocą chlorku żelaza(III) FeCl3. Schemat próby jest podobny do poprzedniego: fragmenty bibuły nasączamy roztworem soli żelaza, a następnie nanosimy roztwory wzorcowe. W obu przypadkach otrzymujemy barwne plamy (fot. 13): czerwoną (anion rodankowy) oraz ciemnoniebieską (anion żelazocyjankowy). Gdy następnie naniesiemy mieszaninę obu anionów, otrzymamy plamę dwubarwną, świadczącą o ich obecności w próbce (fot. 14). W środku znajduje się obszar o ciemnoniebieskim zabarwieniu (anion żelazocyjankowy), a na zewnątrz – o czerwonej barwie (anion rodankowy).
W przypadku wykonania eksperymentu w probówce znacznie intensywniejsza barwa niebieskiego osadu maskuje czerwony kolor pochodzący od anionu SCN–. Dzięki różnej szybkości przemieszczania się otrzymanych połączeń żelaza(III) w porach bibuły możliwe jest oznaczenie obu anionów bez uprzedniego rozdzielania.
Zobacz to na filmach:
- analiza kroplowa - reakcja na płytce
- analiza kroplowa - reakcja na folii
- analiza kroplowa - reakcja na bibule