Lek stulecia - część 1
Skutki niedoboru witaminy C objawiające się szkorbutem były znane już w starożytności. Z tych samych czasów pochodzą wzmianki o przeciwgorączkowych i przeciwbólowych własnościach wyciągów roślinnych zawierających pochodne kwasu salicylowego, czyli prekursora dzisiejszej aspiryny. Były one dobrze znane "ojcu medycyny" - Hipokratesowi (470-360 r. p.n.e.), a na terenach Europy ludowe ziołolecznictwo od niepamiętnych czasów zalecało wywar z kory wierzby w celu obniżenia gorączki.
Nowa "para" najstarszego leku
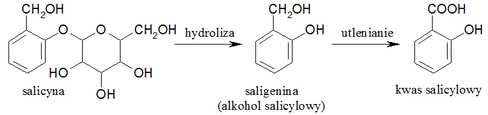
Wiek XIX to "wiek pary i elektryczności", ale i chemii. W tym stuleciu rozpoczęła się nowoczesna historia aspiryny. W roku 1828 niemiecki profesor farmacji Johann Andreas Buchner wyizolował z kory wierzby salicynę (wierzba po łacinie to salix). Jest to połączenie glukozy z alkoholem salicylowym (saligeniną), który po zażyciu przez człowieka rozpada się na składniki, a saligenina utlenia do kwasu salicylowego (poniżej przedstawiono tylko schemat przemian, nie zaś pełne równania reakcji):
Dopiero kwas salicylowy jest właściwym lekiem. W roku 1838 włoski chemik Raffaele Piria otrzymał ten związek w postaci czystej, a w roku 1874 niemiecki chemik Hermann Kolbe opracował metodę jego produkcji przemysłowej.
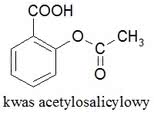
W tym samym czasie zastosowano kwas salicylowy w lecznictwie. Jednak specyfik działał silnie drażniąco na błonę śluzową żołądka, co prowadziło do chronicznych dolegliwości żołądkowych i powstawania owrzodzeń. To właśnie uboczne skutki przyjmowania preparatów kwasu salicylowego skłoniły niemieckiego chemika Feliksa Hoffmanna (1848-1946) do poszukiwania bezpiecznego zamiennika leku (ojciec Hoffmanna leczył się kwasem salicylowym z powodu dolegliwości reumatycznych). „Strzałem w dziesiątkę” było otrzymanie jego pochodnej - kwasu acetylosalicylowego.
Związek powstaje w wyniku estryfikacji grupy OH kwasu salicylowego przy pomocy bezwodnika octowego. Kwas acetylosalicylowy otrzymano już wcześniej, ale dopiero czysty preparat uzyskany przez Hoffmanna w roku 1897 nadawał się do zastosowania w lecznictwie.
Producentem nowego leku była niewielka jeszcze wtedy firma Bayer zajmująca się wytwarzaniem barwników, dziś światowy koncern. Medykament nazwano aspiryną. Jest to zastrzeżona nazwa handlowa Aspirin®, ale stała się ona synonimem leków zawierających kwas acetylosalicylowy (z ang. acetylsalicylic acid, stąd często stosowany skrót ASA). Nazwa pochodzi od słów „acetylowy” (litera a-) oraz Spiraea ulmaria (obecnie Filipendula ulmaria), czyli wiązówka błotna - bylina o dużej zawartości salicyny, również stosowana w ziołolecznictwie jako środek przeciwgorączkowy. Końcówka -in jest zaś typowa dla nazw leków.
Aspirynę opatentowano w roku 1899 i prawie natychmiast okrzyknięto prawdziwym panaceum. [opakowanie] Zwalczała gorączkę, ból i stany zapalne. Na dużą skalę zastosowano ją podczas słynnej "hiszpanki" - pandemii grypy, która w latach 1918-1919 pochłonęła więcej ofiar niż właśnie zakończona pierwsza wojna światowa. Aspiryna była jednym z pierwszych leków sprzedawanych jako tabletki do sporządzania zawiesiny wodnej (w postaci mieszaniny ze skrobią). Po drugiej wojnie światowej zauważono jej korzystne działanie w profilaktyce chorób serca.
Mimo ponad stu lat obecności na rynku aspiryna nadal jest powszechnie stosowana w lecznictwie. To również lek produkowany w największych ilościach (na całym świecie dziennie ludzie przyjmują ponad 35 ton czystego związku!) i pierwszy preparat leczniczy uzyskany w sposób całkowicie syntetyczny, nie zaś wyizolowany z surowców naturalnych.
Kwas salicylowy w naszym laboratorium
Pora na doświadczenia.
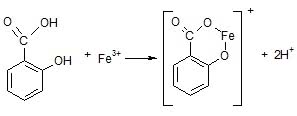
Na początek poznamy charakterystyczną reakcję protoplasty aspiryny - kwasu salicylowego. Potrzebny będzie spirytus salicylowy (środek dezynfekcyjny dostępny w aptekach i drogeriach; 2% wodno-etanolowy roztwór kwasu salicylowego) i roztwór chlorku żelaza(III) FeCl3 o stężeniu ok. 5%. Do probówki wlewamy 1 cm3 spirytusu salicylowego, dodajemy kilka cm3 wody i 1 cm3 roztworu FeCl3. Mieszanina od razu przyjmuje fioletowoniebieskie zabarwienie. Jest to efekt reakcji pomiędzy kwasem salicylowym i jonami żelaza(III):
Kolor przypomina nieco atrament, co jednak nie powinno dziwić – inkaust (jak dawniej nazywano atrament) produkowano z soli żelaza i związków o budowie podobnej do kwasu salicylowego. Wykonana reakcja jest próbą analityczną służącą do wykrywania jonów Fe3+, a równocześnie służy do potwierdzenia obecności fenoli, czyli związków, w których grupa OH jest bezpośrednio przyłączona do pierścienia aromatycznego. Kwas salicylowy należy do tej grupy związków. Dobrze zapamiętajmy tę reakcję – charakterystyczne fioletowoniebieskie zabarwienie po dodaniu chlorku żelaza(III) będzie świadczyć o obecności kwasu salicylowego (ogólnie fenoli) w badanej próbce.
Przeprowadzoną próbę można wykorzystać również do pokazu działania atramentu sympatycznego. Na białej kartce papieru pędzelkiem (wykałaczką, zaostrzoną zapałką, patyczkiem kosmetycznym z wacikiem itp.) wykonujemy dowolny napis lub rysunek spirytusem salicylowym, a następnie suszymy arkusz. Bawełniany płatek kosmetyczny lub wacik zwilżamy roztworem FeCl3 (roztwór działa niszcząco na skórę, obowiązują zatem gumowe rękawice ochronne) i pocieramy nim kartkę papieru. Do zwilżenia kartki można również wykorzystać zraszacz do roślin lub atomizer do perfum i preparatów kosmetycznych. Na papierze pojawiają się fioletowoniebieskie litery uprzednio napisanego tekstu. [atrament] Pamiętajmy, że dla osiągnięcia widowiskowego efektu w postaci nagłego zjawienia się tekstu kluczowa jest niewidoczność sporządzonego uprzednio napisu. Dlatego na białej kartce piszemy bezbarwnymi roztworami, a gdy są one kolorowe – dobieramy barwę papieru tak, aby napis nie odróżniał się od tła (np. na żółtej kartce można wykonać napis roztworem FeCl3 i wywołać go spirytusem salicylowym). Uwaga dotyczy wszystkich atramentów sympatrycznych, a kombinacji dających barwny efekt reakcji jest bardzo wiele.
Wreszcie kwas acetylosalicylowy
Pierwsze próby laboratoryjne już za nami, ale nadal nie dotarliśmy do bohatera dzisiejszego tekstu – kwasu acetylosalicylowego. Nie otrzymamy go jednak samodzielnie, lecz wydzielimy z gotowego preparatu. Powodem nie jest skomplikowana synteza (odczynniki to kwas salicylowy, bezwodnik octowy, etanol, H2SO4 lub H3PO4), ale niezbędna aparatura (kolby ze szlifem, chłodnica zwrotna, termometr, zestaw do sączenia pod zmniejszonym ciśnieniem) i względy bezpieczeństwa. Bezwodnik octowy to ciecz silnie drażniąca, a jego dostępność podlega kontroli – jest tzw. prekursorem narkotykowym.
Potrzebny będzie 95% roztwór etanolu (np. odbarwiony denaturat), kolba (w domowych warunkach można ją zastąpić słoikiem), zestaw do ogrzewania na łaźni wodnej (zwykły metalowy garnuszek z wodą postawiony na gazie), zestaw do sączenia (lejek, sączek) i oczywiście aspiryna w tabletkach. Do kolby wrzucamy 2-3 tabletki leku zawierającego kwas acetylosalicylowy (sprawdźmy skład specyfiku, nie używajmy preparatów rozpuszczających się w wodzie) i wlewamy 10-15 cm3 denaturatu. Kolbę ogrzewamy na łaźni wodnej do całkowitego rozpadnięcia się tabletek (na dno garnuszka kładziemy papierowy ręcznik, aby zapobiec pęknięciu kolby). W tym czasie w lodówce chłodzimy kilkadziesiąt cm3 wody. W skład tabletek aspiryny wchodzą również składniki pomocnicze leku (skrobia, celuloza, talk, substancje poprawiające smak). Są one nierozpuszczalne w etanolu, natomiast rozpuszcza się w nim kwas acetylosalicylowy. Po zakończeniu ogrzewania ciecz szybko sączymy do nowej kolby. Teraz dodajemy schłodzoną wodę, co powoduje wytrącenie kryształów kwasu acetylosalicylowego (w temperaturze 25°C w 100 g etanolu rozpuszcza się ok. 5 g związku, natomiast w takiej samej ilości wody tylko ok. 0,25 g). Kryształy odsączamy i suszymy na powietrzu. Pamiętajmy, że otrzymany związek nie nadaje się do przyjmowania jako lek – do jego wydzielenia użyliśmy przecież skażonego etanolu, a dodatkowo substancja pozbawiona składników ochronnych może zacząć się rozkładać. Związku używamy tylko do naszych doświadczeń.
Jeśli nie chcemy wydobywać kwasu acetylosalicylowego z tabletek, można tylko rozpuścić lek w mieszaninie etanolu z wodą i użyć nieprzesączonej zawiesiny (kończymy procedurę na etapie ogrzewania na łaźni wodnej). Do naszych celów taka postać odczynnika będzie wystarczająca. Teraz proponuję podziałanie na roztwór kwasu acetylosalicylowego roztworem FeCl3 (podobnie jak w pierwszym doświadczeniu).
Czy już domyślasz się, Czytelniku, dlaczego uzyskałeś właśnie taki efekt?