O białkach skrótowo - część 1
Białka to prawdziwy temat-rzeka - nawet gdyby poświecić im cały numer "Młodego Technika", nie byłoby możliwe przedstawienie zagadnień budowy, funkcji, historii i współczesności badań. Dlatego proszę o potraktowanie tego artykułu jedynie jako bardzo skrótowego przedstawienia unikatowej grupy związków organicznych.
Życie jest formą istnienia białka
"Sędziwi technicy" w tytule niniejszego rozdziału rozpoznają fragment tekstu Agnieszki Osieckiej - najpierw śpiewany jako "Lekcja fizyki", a potem jako przebój Skaldów "Nie ma szatana". Choć w komórce rządzą kwasy nukleinowe, to jednak nie ma przesady w twierdzeniu, że białko = życie. DNA w jądrze komórkowym można porównać do mózgu, RNA - do rąk, a wytwarzane przez ten ostatni związek białka - do wyspecjalizowanych narzędzi oraz opakowania dla kwasów. Białka to zatem:
- budulec (keratyna skóry czy kolagen tkanki łącznej),
- transport (hemoglobina krwi),
- magazynowanie (ferrytyna przechowująca zapasy żelaza),
- ruch (miozyna mięśni),
- ochrona (przeciwciała),
- regulacja (hormony),
- reakcje chemiczne (enzymy).
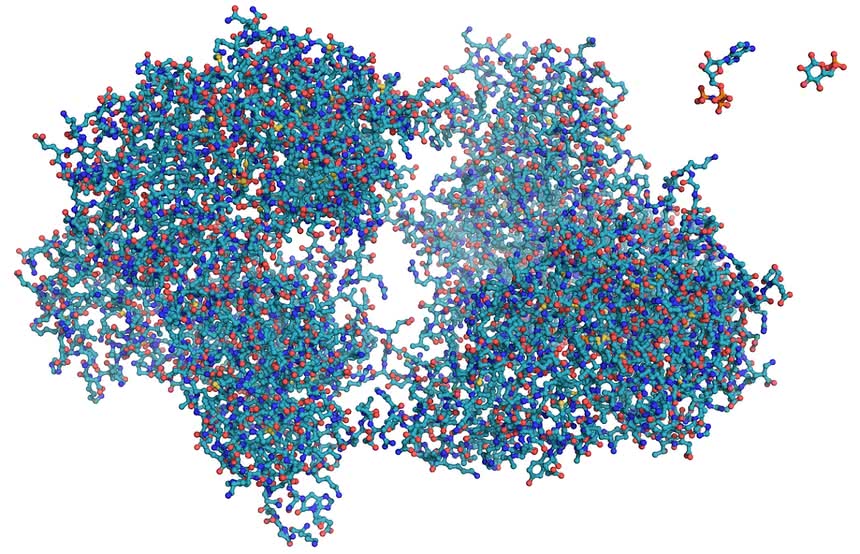
O białkach każdy specjalista (biolog, dietetyk, lekarz) mógłby mówić bardzo długo, my jednak popatrzmy na nie (ilustracja na początku artykułu).
… oczami chemika.
Dla chemika białka to polimery (a właściwie polikondensaty, ponieważ podczas ich tworzenia wydziela się produkt uboczny - woda; pozostańmy jednak przy obiegowym określeniu związków złożonych z wielu mniejszych cząsteczek), zbudowane z aminokwasów połączonych ze sobą wiązaniami peptydowymi. O aminokwasach szczegółowo napiszę w przyszłym miesiącu, teraz tylko popatrzmy na schemat tworzenia wiązań pomiędzy nimi (R1 i R2 to fragmenty cząsteczek niebiorące udziału w reakcji):
Fragment znajdujący się w środku (-CO-NH-) to właśnie wiązanie peptydowe. Oba końce, zarówno z grupą aminową (N-koniec), jak i karboksylową (C-koniec), mogą brać udział w dalszych reakcjach, przedłużając cząsteczkę. Za białka uważane są łańcuchy zawierające co najmniej sto aminokwasów, mniejsze to peptyd.
W skład wszystkich aminokwasów wchodzą węgiel, wodór, tlen i azot. Te pierwiastki - oraz siarkę znajdującą się w metioninie i cysteinie - spotkamy we wszystkich białkach. Oprócz nich w minimalnych ilościach białka zawierają także fosfor i jony niektórych metali. Pierwiastki te nie pochodzą z aminokwasów, lecz z dodatkowych grup modyfikujących własności białek. Skład wagowy przeciętnego białka przedstawia się następująco: 53% węgla, 23% tlenu, 16% azotu, 7% wodoru i 1% siarki. Poszczególne białka wykazują oczywiście odchylenia od podanej średniej, czasem dość znaczne.
O wszystkim decyduje struktura
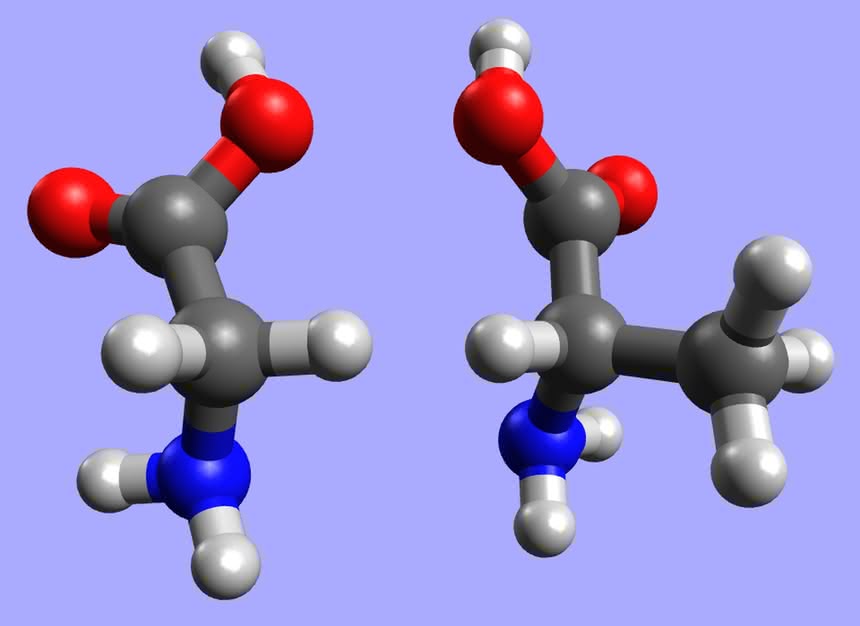
W procesie biosyntezy białka najpierw ze sobą łączą się aminokwasy, przy czym istotna jest ich kolejność. Dla przykładu: glicyna i alanina (w nawiasach znajdują się stosowane skróty nazw i wzorów)
w reakcji nie utworzą jednego produktu, lecz dwa:
Zapisane pod wzorami skróty oznaczają, że w lewym związku N-końcem będzie glicyna, a C‑końcem - alanina (w prawym na odwrót). Oba związki mają różne właściwości: GA to nie to samo co AG (używając jednoliterowych oznaczeń). Dodając do tej pary trzeci aminokwas, np. walinę (Val lub V), powstaje już sześć połączeń: GAV, AGV, GVA, AVG, VGA, VAG (każdy z aminokwasów wzięty tylko jeden raz). Jeśli przypomnisz sobie, że w skład cząsteczki białka może wchodzić kilkaset, a nawet ponad tysiąc aminokwasów z kilkunastu różnych rodzajów, to zauważysz, że liczba możliwych do otrzymania związków jest iście astronomiczna - przekracza liczbę atomów we Wszechświecie, szacowaną na skromne 1080. Kolejność ułożenia aminokwasów w białku zwana jest jego sekwencją, czyli strukturą I-rzędową.
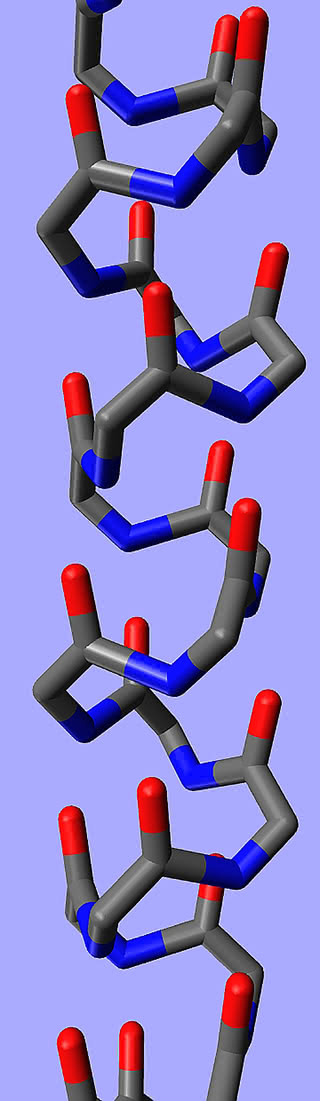
Żadne białko nie występuje w postaci prostego łańcucha aminokwasów. Łańcuchy ulegają skręceniu, a w wyniku tego procesu może powstać spirala (alfa-helisa), pofałdowana w harmonijkę kartka (beta-kartka) lub pętla (łańcuch aminokwasów skręca jak złożony na pół kabel). Powstałe struktury utrzymywane są w całości poprzez różnego rodzaju oddziaływania pomiędzy fragmentami cząsteczek aminokwasów, czasem dość odległych od siebie w łańcuchu. Skręcenie łańcucha to struktura II-rzędowa białka.
Ale na tym nie koniec. Skręcone łańcuchy aminokwasów ponownie splatają się ze sobą, tworząc konstrukcje przestrzenne. To właśnie ten stopień złożoności białek - struktura III‑rzędowa - decyduje przeważnie o ich właściwościach biologicznych. Pamiętajmy jednak, że jest to tylko pochodna sekwencji aminokwasów w łańcuchu. Jeśli w procesie biosyntezy wystąpi błąd (np. dojdzie do wstawienia niewłaściwego aminokwasu do szeregu), to łańcuch nie złoży się odpowiednio w strukturę II-rzędową, a ta potem nie utworzy struktury przestrzennej. Również mutacje genetyczne (czyli wadliwy przepis na kolejność aminokwasów) powodują zazwyczaj powstawanie nieczynnych lub szkodliwych biologicznie białek. Niektóre białka (np. hemoglobina) składają się z kilku oddzielnych struktur przestrzennych, mówimy wtedy o strukturze IV-rzędowej. Zarówno struktury III- jak i IV-rzędowe często zawierają składniki niebędące białkami - inne związki organiczne lub jony metali, które modyfikują ich kształt w sposób umożliwiający działanie. Wiele z tych dodatkowych składników to witaminy lub niezbędne składniki mineralne, stąd zrozumiały staje się ich wpływ na zdrowie człowieka (niedobór powoduje zablokowanie działania białek).
Białka występują w dwóch głównych rodzajach struktur przestrzennych. Pierwsza z nich to białka globularne, w przybliżeniu o kulistym kształcie. Są rozpuszczalne w wodzie i pełnią rolę enzymów, przeciwciał, hormonów i przenośników. Drugi rodzaj to białka fibrylarne o kształcie włókien. Są nierozpuszczalne w wodzie, a w organizmach stanowią budulec (skóra, narządy, struktury komórkowe, mięśnie). Siły wiązania odpowiedzialne za powstawanie poszczególnych rodzajów struktur słabną wraz ze wzrostem ich komplikacji. W przypadku struktury I-rzędowej są to zwykłe, mocne wiązania pomiędzy atomami, natomiast dla struktur najwyższych rzędów - bardzo słabe oddziaływania pomiędzy fragmentami cząsteczki. Dlatego dość łatwo je zerwać, pozbawiając białko czynności biologicznej.
Co niszczy enzym?
Pora na eksperyment. "Królikiem doświadczalnym" będzie białko katalaza, czyli jeden z enzymów. Katalaza rozkłada nadtlenek wodoru, a ponieważ występuje praktycznie u wszystkich organizmów żywych, nie będziesz miał trudności z jej zdobyciem. Obierz małego ziemniaka i utrzyj go na tarce. Masę ziemniaczaną zalej w naczyniu 100-200 cm3 zimnej wody i zamieszaj. Po opadnięciu osadu na dno, zlej ciecz znad niego i najlepiej od razu użyj jej do próby (gdy odkładasz eksperyment na później, wstaw roztwór do lodówki).
Przygotuj cztery probówki i ponumeruj je. Wlej do nich po 5-10 cm3 wyciągu z ziemniaka. Pierwszą pozostaw jako próbkę kontrolną, drugą ogrzewaj do wrzenia przez około minutę. Do jednej z pozostałych wlej 1-2 cm3 roztworu EDTA (kwas wersenowy lub jego sól sodowa), a do drugiej taką samą objętość rozpuszczalnej soli rtęci(II) lub ołowiu(II) o stężeniu ok. 5%.
Pamiętaj o zachowaniu szczególnej ostrożności podczas eksperymentowania ze związkami tych metali!
Probówki umieść w statywie, a następnie postaw go na tacy. Teraz do każdej z nich wlej 1-2 cm3 wody utlenionej (3% roztwór H2O2). W pierwszej probówce zachodzi burzliwa reakcja, a powstająca piana wypływa z naczynia (już chyba wiesz, dlaczego radziłem eksperymentować na tacy). Za to w pozostałych probówkach nie widać oznak reakcji.
Katalaza jest białkiem, więc wysoka temperatura spowodowała nieodwracalną zmianę struktury cząsteczki (po prostu białko się ugotowało) i utratę zdolności katalitycznych. EDTA połączyła się z obecnym w centrum enzymu jonem żelaza i w ten sposób zablokowała je - efekt jak wyżej. Z kolei jony metalu ciężkiego zmieniły strukturę całej cząsteczki, również powodując unieczynnienie enzymu. Nieodwracalna zmiana struktury białka powodująca utratę jego aktywności to denaturacja.
Jeśli nie chcesz wyciskać soku z ziemniaka (tak też otrzymasz roztwór katalazy) lub moczyć utartego kartofla w wodzie, również możesz przeprowadzić opisany eksperyment. Wybierz dużego ziemniaka i przekrój go na pół. Próby prowadź na oddalonych od siebie częściach bulwy. Jeden fragment przypiecz, przykładając rozgrzaną do czerwoności blaszkę stalową lub miedzianą. Wybrany fragment polej roztworem EDTA, a inny - soli metalu ciężkiego (ziemniak nie będzie nadawał się już do spożycia). Na powierzchnię nalej teraz wody utlenionej. Pienienie zaobserwujesz tylko we fragmencie, który nie był podgrzany, ani polany roztworami.
Denaturacja na fioletowo
Rozbij jajko i oddziel żółtko od białka. Łyżkę tego ostatniego rozpuść w połowie szklanki wody. Nalej 5-10 cm3 roztworu białka do probówki i dodaj kilka cm3 roztworu wodorotlenku sodu NaOH, a następnie błękitnej barwy roztworu siarczanu(VI) miedzi(II) CuSO4. W probówce powstaje fioletowe zabarwienie, a w przypadku większego stężenia białka - również „kluch” zdenaturowanej substancji organicznej. Wykonane doświadczenie to próba biuretowa.
Reakcja jest charakterystyczna dla białek i peptydów, a wykrywa obecność wiązań peptydowych położonych obok siebie i przedzielonych co najwyżej jednym atomem węgla. Powstaje wtedy związek kompleksowy miedzi(II) o fioletowej barwie. W przypadku małego stężenia białek nie dochodzi do wytrącenia osadu, ale tylko do zmiany barwy roztworu. Próbę wykorzystuje się m.in. w analityce medycznej do wykrywania białek w płynach ustrojowych (intensywność zabarwienia jest proporcjonalna do ich stężenia). Nazwa próby pochodzi od najprostszej budowy związku, który daje pozytywny wynik - biuretu. Jest to popularna nazwa dwumocznika (łac. bi = dwu, urea = mocznik), związku powstałego z kondensacji dwóch molekuł mocznika.
Temperatura i sole metali ciężkich to nie jedyne czynniki, które powodują denaturację białek. Nie jest zatem przesadą stwierdzenie, że z białkiem należy postępować jak z przysłowiowym jajkiem.