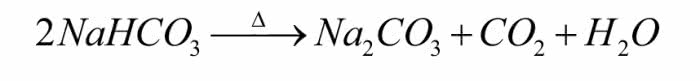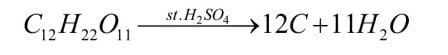Mokre związki - część 1
Woda to wszędobylska substancja na Ziemi i nic dziwnego, że można ją znaleźć również w składzie innych związków chemicznych. Bywa z nimi luźno związana, uwięziona w ich wnętrzu, występuje w postaci ukrytej lub też jawnie buduje strukturę kryształów.
Ale po kolei. Na początek…
…wilgoć
Wiele związków chemicznych ma skłonności do pochłaniania wody z otoczenia - chociażby znana wszystkim sól kuchenna, która często zbryla się w zaparowanej, wilgotnej atmosferze kuchni. O takich substancjach mówimy, że są higroskopijne, a związana przez nie wilgoć to woda higroskopijna. Jednak sól kuchenna potrzebuje dość dużej wilgotności względnej (patrz ramka: Ile wody jest w powietrzu?), aby wiązać parę wodną. Tymczasem istnieją substancje, które i na pustyni potrafią chłonąć wodę z otoczenia.
Wilgotność bezwzględna to ilość pary wodnej zawartej w jednostce objętości powietrza w danej temperaturze. Na przykład w 0°C w 1 m3 powietrza może znaleźć się maksymalnie (tak, aby nie nastąpiło skraplanie pary) ok. 5 g wody, w 20°C - ok. 17 g wody, a w 40°C - już ponad 50 g. W ciepłej kuchni lub łazience jest więc dość mokro.
Wilgotność względna to iloraz ilości pary wodnej znajdującej w jednostce objętości powietrza do ilości maksymalnej w danej temperaturze (wyraża się ją w procentach).
Do przeprowadzonego za moment eksperymentu potrzebny będzie wodorotlenek sodu NaOH lub potasu KOH. Umieść pastylkę związku (w takiej postaci są one sprzedawane) na szkiełku zegarkowym i pozostaw na pewien czas na powietrzu. Wkrótce zauważysz, że pastylka zaczyna pokrywać się kroplami cieczy, a następnie rozpływać. To właśnie efekt higroskopijnej natury NaOH lub KOH. Umieszczając próbki w różnych pomieszczeniach domu, porównasz wilgotności względne tych miejsc (1).
Chemicy, i nie tylko oni, borykają się z problemem zawilgocenia substancji. Woda higroskopijna stanowi uciążliwe zanieczyszczenie związku chemicznego, a jej zawartość w dodatku nie jest stała. Ten fakt utrudnia odważenie ilości odczynnika potrzebnej do reakcji. Rozwiązaniem jest oczywiście wysuszenie substancji. Na skalę przemysłową odbywa się to w ogrzewanych komorach, czyli większej wersji domowego piekarnika.
W laboratoriach, oprócz elektrycznych suszarek (znowu piekarniki), stosuje się eksykatory (także do przechowywania już wysuszonych odczynników). Są to szklane naczynia, szczelnie zamknięte, na których dnie umieszczona jest silnie higroskopijna substancja (2). Jej zadaniem jest pochłanianie wilgoci z suszonego związku oraz utrzymywanie niskiej wilgotności wewnątrz eksykatora.
Przykładowe substancje suszące to: bezwodne sole CaCl2 i MgSO4, tlenki fosforu(V) P4O10 i wapnia CaO oraz żel krzemionkowy (silikażel, ang. silica gel). Ten ostatni spotkasz również jako zawartość pochłaniających wilgoć saszetek umieszczonych w opakowaniach produktów przemysłowych i spożywczych (3).
Wiele substancji suszących można zregenerować, gdy pochłoną już zbyt dużo wody - wystarczy je ogrzać.
Zanieczyszczeniem związków chemicznych jest również woda zaokludowana. Dostaje się ona do wnętrza kryształów podczas ich szybkiego wzrostu i tworzy przestrzenie wypełnione roztworem, z którego powstaje kryształ, otoczone substancją stałą. Banieczek cieczy w krysztale można się pozbyć, rozpuszczając związek i ponownie go krystalizując, ale tym razem w warunkach, które spowodują powolny wzrost kryształu. Cząsteczki będą wtedy układać się "porządnie" w sieć krystaliczną, bez pozostawiania luk.
Ukryta woda
W niektórych związkach woda występuje w postaci ukrytej, ale i z nich chemik jest w stanie ją wydobyć. Możesz przyjąć, że z każdego związku, w którego skład wchodzą tlen i wodór, w odpowiednich warunkach wydzielisz wodę. Zmusisz go do oddania wody przez ogrzewanie lub działaniem innej, silnie pochłaniającej wodę substancji. Woda w takich związkach to woda konstytucyjna. Wypróbuj obie metody odwadniania związków chemicznych.
Do probówki wsyp nieco sody oczyszczonej, czyli wodorowęglanu sodu NaHCO3. Dostaniesz ją w sklepie spożywczym, a w kuchni używana jest m.in. jako środek spulchniający do wypieków (ale ma również wiele innych zastosowań).
Probówkę ustaw w płomieniu palnika pod kątem ok. 45° i tak, aby jej wylot był skierowany w przeciwną stronę niż Ty. To jedna z zasad laboratoryjnego BHP - zabezpieczasz się w ten sposób na wypadek nagłego wyrzucenia ogrzewanej substancji z probówki.
Ogrzewanie nie musi być silne, reakcja rozpocznie się już w temperaturze 60°C (wystarczy palnik na denaturat lub nawet świeczka). Obserwuj górną część naczynia. Jeżeli probówka jest dość długa, u wylotu zaczną się zbierać kropelki cieczy (4). Jeśli ich nie widzisz, nad wylotem probówki umieść zimne szkiełko zegarkowe - na nim skropli się para wodna wydzielana w reakcji rozkładu sody oczyszczonej (symbol D nad strzałką oznacza ogrzewanie substancji):
Drugi z produktów gazowych - dwutlenek węgla - wykryjesz przy pomocy wody wapiennej, czyli nasyconego roztworu wodorotlenku wapnia Ca(OH)2. Jej zmętnienie, powodowane wytrącaniem osadu węglanu wapnia, to dowód obecności CO2. Wystarczy na bagietkę nabrać kroplę roztworu i umieścić ją u wylotu probówki. Jeśli nie masz wodorotlenku wapnia, wodę wapienną przygotujesz przez dodanie roztworu NaOH do roztworu dowolnej rozpuszczalnej w wodzie soli wapnia.
W kolejnym doświadczeniu użyjesz następnego kuchennego odczynnika - zwykłego cukru, czyli sacharozy C12H22O11. Potrzebny będzie jeszcze stężony roztwór kwasu siarkowego (VI) H2SO4.
Od razu przypominam zasady pracy z tym niebezpiecznym odczynnikiem: obowiązują gumowe rękawice ochronne na ręce i okulary na oczy, a eksperyment przeprowadzasz na plastikowej tacy lub folii polietylenowej.
Do małej zlewki wsyp cukier w ilości wypełniającej naczynie w połowie. Teraz wlej roztwór kwasu siarkowego w ilości równej połowie wsypanego cukru. Zawartość zamieszaj bagietką szklaną, aby równomiernie rozprowadzić kwas w całej objętości. Przez chwilę nic się nie dzieje, ale nagle cukier zaczyna ciemnieć, potem staje się czarny, a na koniec zaczyna "wychodzić" z naczynia.
Porowata czarna masa, w niczym nieprzypominająca już białego cukru, wydobywa się ze zlewki jak wąż z koszyka fakira. Całość rozgrzewa się, widać kłęby pary wodnej, a nawet słychać syczenie (to także para wodna ulatniająca się ze szczelin).
Doświadczenie jest atrakcyjne, z kategorii tzw. chemicznych węży (5). Za obserwowane efekty odpowiada higroskopijność stężonego roztworu H2SO4. Jest ona tak duża, że roztwór odbiera wodę z innych substancji, w tym przypadku z sacharozy:
Pozostałości po odwodnieniu cukru zostają nasycone parą wodną (pamiętasz, że podczas mieszania stężonego roztworu H2SO4 z wodą wydziela się dużo ciepła), co powoduje znaczne zwiększenie ich objętości i efekt wyrastania masy ze zlewki.
Uwięziona w krysztale
I jeszcze jeden rodzaj wody zawartej w związkach chemicznych. Tym razem występuje ona jawnie (w przeciwieństwie do wody konstytucyjnej), a jej ilość jest ściśle określona (nie zaś dowolna, jak w przypadku wody higroskopijnej). To woda krystalizacyjna, która nadaje barwę kryształom - pozbawione jej rozpadają się na bezpostaciowy proszek (o czym zaraz przekonasz się doświadczalnie, jak na chemika przystało).
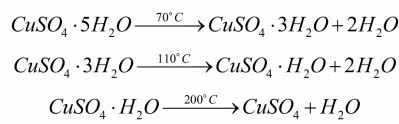
Zaopatrz się w błękitne kryształy uwodnionego siarczanu(VI) miedzi(II) CuSO4×5H2O, jednego z najpopularniejszych odczynników laboratoryjnych. Niewielką ilość drobnych kryształów wsyp do probówki lub parowniczki (drugi sposób jest lepszy, ale w przypadku niewielkiej ilości związku można użyć i probówki; więcej o tym za miesiąc). Rozpocznij ostrożne ogrzewanie nad płomieniem palnika (wystarczy lampka na denaturat).
Często potrząsaj probówką, zwróconą w odwrotną stronę, niż stoisz, lub mieszaj bagietką w parowniczce umieszczonej w uchwycie statywu (nie nachylaj się nad naczyniem). W miarę wzrostu temperatury barwa soli zaczyna blednąć, aż w końcu staje się prawie biała. Równocześnie w górnej części probówki zbierają się kropelki cieczy. To woda usunięta z kryształów soli (gdy ogrzewasz je w parowniczce, wodę wykryjesz, ustawiając zimne szkiełko zegarkowe nad naczyniem), które tymczasem rozpadły się na proszek (6). Odwodnienie związku zachodzi etapami:
Dalszy wzrost temperatury ponad 650ºC powoduje rozkład soli bezwodnej. Biały proszek bezwodnego CuSO4 przechowuj w szczelnie zakręcanym naczyniu (możesz do niego włożyć saszetkę pochłaniającą wilgoć).
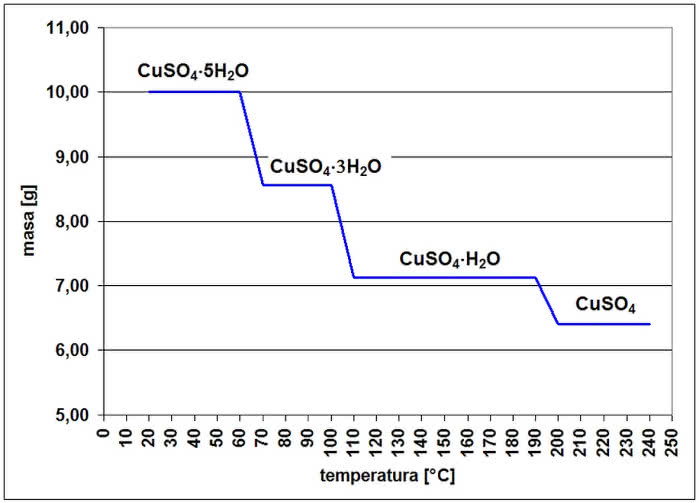
Zapytasz może: skąd wiemy, że odwodnienie zachodzi w opisany równaniami sposób? Albo dlaczego związek ma taki właśnie wzór? Ustaleniem ilości wody w tej soli zajmiesz się w przyszłym miesiącu, teraz odpowiem na pierwsze pytanie. Metoda, przy pomocy której możemy obserwować zmiany masy substancji zachodzące wraz ze wzrostem temperatury, to analiza termograwimetryczna. Badaną substancję umieszcza się na szalce tzw. termowagi i ogrzewa, odczytując zmiany masy.
Oczywiście dzisiaj termowaga sama zapisuje dane, kreśląc przy okazji odpowiedni wykres (7). Kształt krzywej wykresu wskazuje, przy jakiej temperaturze "coś" się dzieje, np. ze związku wydziela się lotna substancja (ubytek masy) lub łączy się on z gazem z powietrza (wtedy masa wzrasta). Zmiana masy pozwala zaś stwierdzić, co i w jakiej ilości ubyło albo przybyło.
Uwodniony CuSO4 ma prawie taką samą barwę jak jego wodny roztwór. Nie jest to przypadek. W roztworze jon Cu2+ otoczony jest przez sześć cząsteczek wody, natomiast w krysztale - przez cztery leżące w narożach kwadratu, którego jest środkiem. Nad i pod jonem metalu znajdują się aniony siarczanowe, z których każdy "obsługuje" po dwa sąsiadujące kationy (zatem stechiometria się zgadza). Gdzie natomiast podziewa się piąta cząsteczka wody? Leży pomiędzy jednym z jonów siarczanowych a molekułą wody z pasa otaczającego jon miedzi(II).
I znów dociekliwy Czytelnik zapyta: a skąd to wiadomo? Tym razem z obrazów kryształów uzyskanych w wyniku naświetlania ich promieniami rentgenowskimi. Natomiast wyjaśnienie, dlaczego bezwodny związek jest biały, a uwodniony ma barwę błękitną, to już zaawansowana chemia. Na nią przyjdzie pora na studiach.
Krzysztof Orliński