Chemiczny Nobel 2020, czyli genetyczne nożyce
- Znowu biochemia - westchnie zapewne niejeden "klasyczny" chemik. To prawda, ale nagroda nawiązuje do wyróżnienia z roku 2016 przyznanego za zaprojektowanie i syntezę maszyn molekularnych. Jak przeczytasz w dalszej części artykułu, chemii będzie całkiem sporo i to znacznie bardziej złożonej i fascynującej, niż na co dzień widzisz w probówce. Chemiczny Nobel 2020 ma jednak jeszcze jedną bohaterkę, o której nie wszystkie media wspomniały. Oprócz nagrodzonych laureatek jest to…
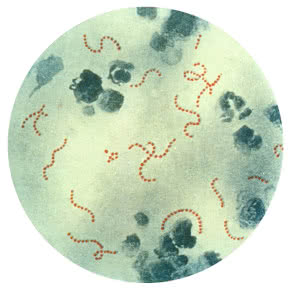
…Streptococcus pyogenes…
…bakteria z rodzaju paciorkowców, często występująca w postaci komórek połączonych ze sobą jak sznur koralików. Zadecydowanie nieprzyjemna osobistość, polska nazwa - paciorkowiec ropny - dobrze oddaje jej cechy. Drobnoustrój wywołuje szereg chorób, np. anginę, różę, płonicę, różnego rodzaju zapalenia, martwicę tkanek oraz sepsę. Bakteria żyje w otoczeniu człowieka i w jego organizmie. Na szczęście jest wrażliwa na zwykłe środki dezynfekujące i standardowo stosowane antybiotyki. Jej powszechne występowanie powoduje, że jest często badana w laboratoriach (1).
I bakterie chorują
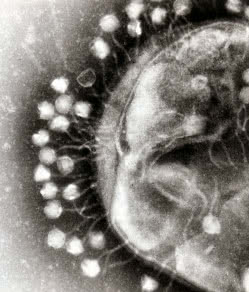
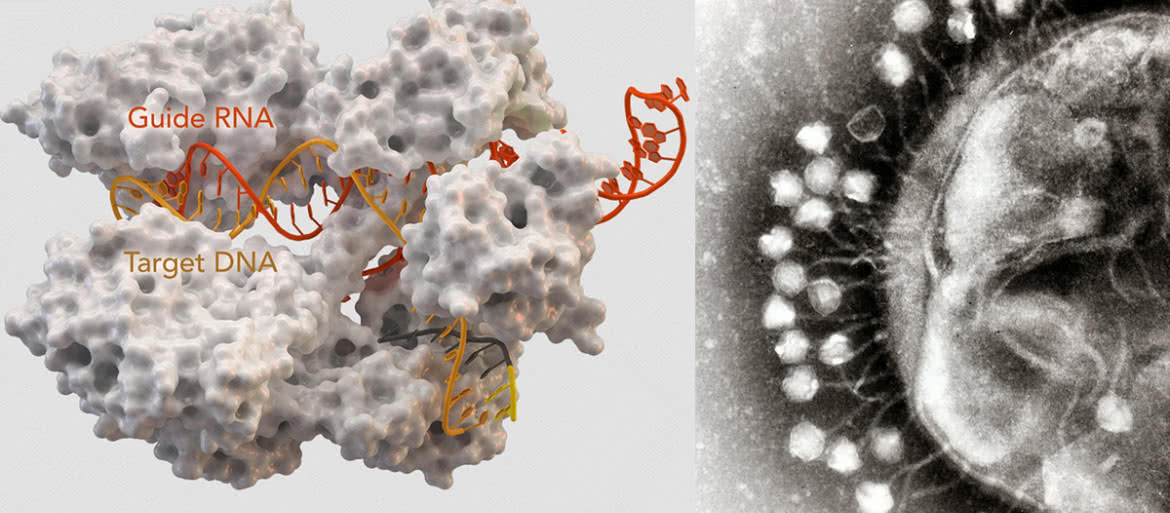
Każdy, nawet najgroźniejszy organizm, ma swojego wroga. Chorobotwórcze bakterie nie stanowią tu wyjątku. Ich prześladowcami są twory o jeszcze mniejszych rozmiarach - bakteriofagi, czyli wirusy atakujące bakterie (dosłownie "pożeracze bakterii"). Mechanizm infekcji nie jest skomplikowany. Wirus to materiał genetyczny (DNA lub RNA) zamknięty w białkowej otoczce zwanej kapsydem. Całość z wyglądu często przypomina przedmiot będący wytworem techniki, ale kształt spowodowany jest dostosowaniem do sposobu działania. Wirus przyczepia się do ściany komórki baterii, przebija ją i wstrzykuje do wnętrza tylko swój kwas nukleinowy. Materiał genetyczny wirusa wykorzystuje mechanizmy powielania zawarte w komórce do namnażania swoich kopii (materiału genetycznego oraz białkowych otoczek). Gdy komórka jest już pełna nowych wirusów, ulega destrukcji, a uwolnione bakteriofagi ponownie ruszają na łowy. Ten sam mechanizm działa w przypadku wirusów atakujących rośliny i zwierzęta, z człowiekiem włącznie (2).
Komórki nie są jednak bezbronne, inaczej wirusy już dawno unicestwiłyby życie na Ziemi. Potrafią rozpoznać obce DNA lub RNA i zniszczyć go, zanim spowoduje szkody. O tym wiedziano już od dawna. Nowością było odkrycie dokonane w roku 1987 przez japońskiego mikrobiologa Yoshizumi Ishino. Okazało się, że w genomie powszechnie bytującej w naszych jelitach Escherichia coli (pałeczka okrężnicy) występują powtarzające się w regularnych odstępach sekwencje materiału genetycznego. Najbardziej jednak interesujące były fragmenty, które one oddzielały.
W roku 2005 (w międzyczasie analogiczne sekwencje odkryto i u innych bakterii) zidentyfikowano je jako pochodzące od wirusów zwykle infekujących komórki tych bakterii. W ten sposób potwierdzono nasuwające się od początku przypuszczenia: jest to swoista "baza sygnatur wirusów" służąca do rozpoznawania i niszczenia bakteriofagów (skojarzenie z oprogramowaniem chroniącym komputery jest jak najbardziej na miejscu). Bakteryjnemu układowi odpornościowemu nadano nazwę CRISPR. Słowo jest akronimem od Clustered Regularly Interspaced Short Palindromic Repeats, czyli zgrupowane, regularnie rozproszone, krótkie, powtarzające się sekwencje palindromiczne (powtarzające się fragmenty zapisane za pomocą liter kodu genetycznego stanowią palindromy, np. AGTTGA). Nadal jednak nic nie wiedziano o funkcjonowaniu systemu.
Współdziałają: białko…
Wkrótce o odkryciu systemu CRISPR usłyszała Jenifer Doudna (3). Jej zawodowe zainteresowania obejmowały interferencję RNA, czyli zjawisko wyłączania działania genów przez niewielkie cząsteczki RNA o budowie zbliżonej do struktury danego genu. W tym czasie odkryto również znajdujący się zawsze w pobliżu odcinka CRISPR gen nazwany Cas (skrót od CRISPR-associated, czyli skojarzony z CRISPR).
Doudna zauważyła, że gen jest bardzo podobny do genów kodujących białka potrafiące rozwijać i dzielić na części nici DNA. W ciągu kilkuletnich badań jej zespołu okazało się, że system CRISPR/Cas (tak go nazwano) występuje w dwóch klasach z wieloma typami. W skład systemów klasy 1 wchodzi wiele białek Cas, natomiast systemy klasy 2 mają znacznie prostszą budowę - ich działanie wymaga tylko jednego białka. Pozostawało jeszcze zagadką, jak system rozpoznaje wroga.
…i RNA
Emmanuelle Charpentier (4) również interesowała się mechanizmem regulacji genów przez RNA. W toku swoich badań analizowała budowę małej cząsteczki RNA znajdowanej w dużych ilościach we wspomnianej już wcześniej trzeciej bohaterce - bakterii Streptococcus pyogens. Zastanowiło ją, że struktura molekuły jest bardzo podobna do elementów budujących CRISPR w genomie. Badania laureatki dowiodły, że odkryta molekuła stanowi brakujący element systemu CRISPR/Cas i odpowiada za rozpoznawanie fragmentu DNA wirusa, który należy przeciąć. Cząsteczkę nazwano trancrRNA, od trans-activating crispr RNA, czyli aktywującą CRISPR (fragment DNA, który ją koduje, znajduje się w oddaleniu od aktywowanego - stąd trans, gdyby znajdował się w pobliżu, przedrostkiem byłoby słowo cis).
Emmanuelle Marie Charpentier (ur. 1968, w Juvisy-sur-Orge we Francji) jest mikrobiologiem, genetykiem i biochemikiem. Kieruje berlińskim instytutem badawczym Towarzystwa Maxa Plancka zajmującym się czynnikami infekcyjnymi (Max-Planck-Institut für Infektionsbiologie). Jej życiowe motto to słowa Ludwika Pasteura: Przypadek sprzyja jedynie umysłom przygotowanym.
Jennifer Anne Doudna (ur. 1964 w Waszyngtonie) jest biochemikiem i biologiem molekularnym. Pracuje na Uniwersytecie Kalifornijskim w Berkeley.
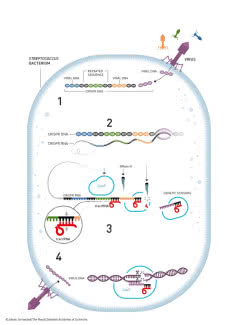
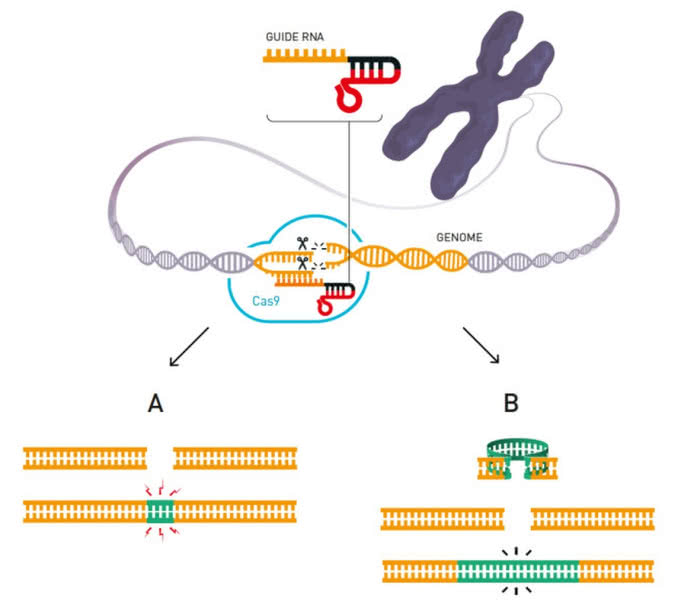
System CRISPR/Cas9 u naszej bakterii należy do klasy 2 i zawiera specyficzne białko zwane Cas9. Jeżeli bakteria przeżyje atak wirusa, wbudowuje fragment jego DNA w obszar CRISPR swojego genomu (etap 1 na załączonej ilustracji (5)). Na podstawie uzyskanego wzorca tworzą się cząsteczki trancrRNA (etapy 2 i 3), które w połączeniu z białkiem Cas9 rozpoznają DNA wirusa infekującego bakterię. Kompleksy krążą w cytoplazmie bakterii jak przeciwciała w naszej krwi. W razie ponownej infekcji kompleks przyłącza się do materiału genetycznego napastnika (w miejscu wyznaczonym przez trancrRNa), a białko Cas9 tnie go na fragmenty jak nożyce wstążkę (etap 4).
Przełomowa współpraca
Emmanuelle Carpentier ogłosiła swoje odkrycie w marcu 2011 roku i wkrótce po tym pojechała na konferencję naukową do Puerto Rico. Spotkała tam inną jej uczestniczkę - Jenifer Doudnę. Obie panie wymieniły się wynikami swoich badań i postanowiły kontynuować je razem. Na sukces nie trzeba było długo czekać.
Na początku udowodniły prawdziwość przedstawionego wyżej mechanizmu działania systemu antywirusowego. Po wprowadzeniu białka Cas do probówki zawierającej wirusowe DNA nic się nie działo - enzym nie niszczył materiału genetycznego. Dopiero dodatek odpowiedniego trancrRNA spowodował szybkie pocięcie DNA na fragmenty (6).
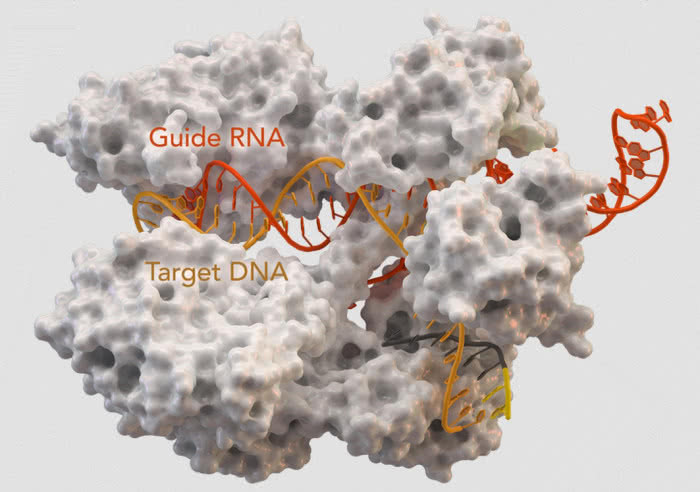
Ale to nie koniec. Panie postanowiły wykorzystać odkryty mechanizm do stworzenia specyficznego narzędzia. W tym celu zespoły obu uczonych zsyntezowały cząsteczkę trancrRNA, w której wzorzec (zwany guide RNA) pasował do wybranego fragmentu molekuły DNA. Po dodaniu białka Cas9, genetyczne nożyce (białko połączone z RNA) rozcięły nić materiału genetycznego dokładnie w miejscu odpowiadającym wzorcowi. Wcale nie będzie przesady w stwierdzeniu, że w genetyce rozpoczęła się…
…nowa epoka
Wyniki badań ogłoszono w roku 2012 i już wkrótce inne zespoły uczonych doniosły o fascynujących możliwościach narzędzia. Za jego pomocą udaje się usuwać dowolny fragment genomu, a mechanizmy naprawcze komórki "łatają" powstałą dziurę tak, aby zachować całość DNA. Inny osiągnięciem jest wycinanie fragmentu DNA i wstawienie w jego miejsce innego, co prowadzi do np. zastąpienia jednego genu drugim (7).
Obecnie genetyczne nożyce stały się standardowym narzędziem do modyfikacji DNA roślin: wprowadzania genów zapewniających odporność na choroby i szkodniki (co pozwala na zmniejszenie zużycia środków ochrony roślin) czy też ułatwiających przystosowanie do warunków klimatycznych lub zwiększenie plenności. Można również "wyłączyć" geny odpowiedzialne za cechy niekorzystne dla uprawy i konsumenta, np. genetycznie modyfikowany ryż wchłania mniej metali ciężkich z gleby (8). Podobne modyfikacje prowadzi się w przypadku zwierząt laboratoryjnych.
Przydatność nowego narzędzia jest intensywnie badana w kontekście zastosowań medycznych. Potencjalne możliwości są ogromne. Nożyce mogłyby pociąć DNA komórek nowotworowych. W ten sam sposób można również niszczyć wirusy infekujące organizm. Ale najbardziej fascynująca jest możliwość naprawy wadliwego DNA, czyli leczenia chorób genetycznych.
Jednak narzędzie może zachęcić niektórych do "zabawy w Boga", czyli genetycznych modyfikacji DNA człowieka tak, aby np. urodziło się dziecko z "zamówionymi" przez klienta cechami. Regulacje prawne są zatem niezbędne, ponieważ nie pierwszy raz osiągnięcia nauki niosą potencjalne zagrożenia. Obawy najlepiej oddają słowa Jennifer Doudny: Moc kontrolowania genetycznej przyszłości naszego gatunku jest niesamowita i przerażająca. Decyzja, jak sobie z tym poradzić, może być największym wyzwaniem, przed jakim kiedykolwiek stanęliśmy.
Ubiegłoroczne osiągnięcia chemików nie spotkały się z uznaniem redakcji dwumiesięcznika "Annals of Improbable Research" (AIR) i jubileuszowa, 30. już edycja IgNobli, nie przyniosła im wyróżnienia. Czy to powód do radości (chemicy zajmują się samymi poważnymi badaniami), czy też do smutku (trochę szkoda nagrody)? Trudno rozstrzygnąć, zwłaszcza że Marc Abrahams, wydawca AIR, jak zwykle zakończył ceremonię wręczenia nagród zdaniem: Jeśli nie dostałeś dzisiaj nagrody IgNobla, a szczególnie jeśli ją dostałeś, życzymy więcej szczęścia w przyszłym roku.
Krzysztof Orliński