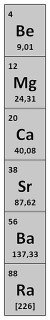
Grupa druga. Berylowce - część 1

Berylowce są trochę mniej aktywne niż litowce (jeśli porównać leżące obok siebie pierwiastki), ich związki są trudniej rozpuszczalne w wodzie, a własności metaliczne nieco mniej zaznaczone. Nie sądź jednak, że berylowce to pierwiastki "drugiej kategorii". Znaczenie kilku z nich w gospodarce i świecie ożywionym plasuje je w czołówce najbardziej użytecznych substancji.
Metal według chemika
Charakter metaliczny (tak jak to pojęcie rozumie chemik) polega na oddawaniu elektronów: im atomy łatwiej się ich pozbywają, tym u pierwiastka wyraźniej występują cechy metalu. W poszczególnych grupach charakter metaliczny rośnie przy przechodzeniu do coraz cięższych członków rodziny. Powodem jest coraz słabsze przyciąganie najbardziej zewnętrznych elektronów, decydujących o własnościach chemicznych, przez jądro. To z kolei konsekwencja prawa Coulomba opisującego siłę oddziaływania pomiędzy ładunkami.
Cięższy pierwiastek ma większy ładunek jądra (licznik wzoru Coulomba to iloczyn ładunków), ale również wzrasta odległość elektronów jego zewnętrznej powłoki od centrum atomu (w mianowniku znajduje się jej kwadrat). Drugi czynnik przeważa i najbardziej metaliczne pierwiastki położone są na dole swoich grup. Jeżeli zaś porównać pierwiastki leżące obok siebie, to wyraźniejszy charakter metaliczny ma ten po lewej stronie. Tym razem zgodnie działają oba czynniki ze wzoru: większy rozmiar atomu i ładunek jądra mniejszy o jednostkę. Takie też jest wyjaśnienie nieco niższej aktywności berylowców w porównaniu z sąsiadującymi litowcami. Ponadto pierwiastki grupy drugiej oddają po dwa elektrony, co jest trudniejsze niż pozbycie się tylko jednego w przypadku litowców.
O berylowcach w skrócie
Berylowce to metale o wyższych temperaturach topnienia niż litowce. Są one również twardsze i nie korodują tak szybko. Z wyglądu srebrzystoszare, na powietrzu pokrywają się ochronnymi nalotami. Nie występują w postaci wolnej, lecz jako dwudodatnie kationy tworzą związki jonowe. Jedynie beryl, najlżejszy z nich, ma również połączenia o charakterze kowalencyjnym (niejonowe). Potoczna nazwa berylowców - metale ziem alkalicznych - pochodzi od tworzenia przez ich tlenki (dawniej zwane ziemiami) roztworów o odczynie zasadowym (1).
Wapń i magnez są często spotykane w świecie minerałów: wapnia w powierzchniowej warstwie Ziemi jest ok. 3,5% (5. miejsce na liście rozpowszechnienia pierwiastków), a magnezu ok. 2% (8. miejsce). Ich związki budują całe pasma górskie, a i świat ożywiony wiele im zawdzięcza. Dwa następne metale są substancjami o średnim rozpowszechnieniu: bar zajmuje 18. miejsce (0,024%), a stront 21. (0,015%). Pozostałych pierwiastków grupy drugiej jest mało: berylu mamy tylko ok. 0,0006% (44. miejsce), a najcięższy rad stanowi śladową domieszkę w minerałach uranu i toru (w tonie rudy znajdują się co najwyżej dziesiąte części grama radu).
Sobowtór glinu
Choć pierwiastek beryl został odkryty u schyłku XVIII wieku, jego minerały znano i ceniono od tysiącleci. Około 4 tysięcy lat temu starożytni Egipcjanie rozpoczęli eksploatację położonych nad Morzem Czerwonym, sławnych na cały ówczesny świat, kopalni beryli. Kupieckie karawany rozwoziły szlachetne kamienie w najdalsze strony - dotarły one aż do Indii i Chin. Za panowania królowej Kleopatry Rzymianie rozpowszechnili je w całej Europie. Jak głosi legenda, złej sławy cesarz Neron, będący krótkowidzem, używał oszlifowanego szmaragdu (odmiana berylu). W późniejszych wiekach to zastosowanie beryli dało niemiecką nazwę okularom - die Brille.
Beryle, najważniejszy surowiec do produkcji metalicznego berylu i jego związków, to glinokrzemiany tego pierwiastka. Niektóre jego odmiany to kamienie szlachetne: zielony szmaragd, błękitny akwamaryn (z łac. aqua marina = woda morska), złocisty heliodor oraz bezbarwne kryształy imitujące diamenty (2). W XVIII wieku chemicy zaczęli analizować skład beryli. Początkowo uważano, że tworzy je krzemionka (SiO2) wraz z ziemią glinkową (Al2O3). Dopiero w roku 1798 francuski chemik Louis Nicolas Vauquelin stwierdził, że beryle zawierają jeszcze jedną ziemię (3). Nowemu pierwiastkowi nadano nazwę glucyn i symbol Gl od słodkiego smaku jego soli (z gr. glykos = słodki, stąd m.in. glukoza), ale potem zmieniono ją na taką, jaką nosi minerał, w którym został odkryty. Obecnie nikt już nie próbuje związków berylu, ponieważ są trujące, a wdychany pył berylowy powoduje ciężkie schorzenia dróg oddechowych.
Beryl jest dość twardym metalem o wysokiej temperaturze topnienia. Na powietrzu i w środowisku utleniającym pasywuje, czyli pokrywa się ochronną warstwą tlenku, która chroni go przed dalszą korozją. Podobnie jak pozostałe berylowce tworzy związki jonowe (kation Be2+), ale również - inaczej niż reszta rodziny - liczne połączenia kowalencyjne. Oprócz typowych własności metalicznych wykazuje amfoteryczność, np. wodorotlenek berylu rozpuszcza się w kwasach i zasadach. Czołowy pierwiastek grupy drugiej przypomina glin, leżący po "przekątnej" w grupie 13 (reguła diagonalnego podobieństwa). Chemiczne podobieństwo berylu do glinu przysporzyło kłopotów podczas tworzenia tablicy układu okresowego. Beryl przez lata uważano za pierwiastek trójwartościowy i dopiero Mendelejew odważnie zmienił jego wartościowość na równą dwa (przy okazji korygując masę atomową). Późniejsze badania potwierdziły prawdziwość tych przewidywań (4).
Ze związków berylu najważniejsze znaczenie gospodarcze ma tlenek BeO stosowany jako materiał ognioodporny, składnik cementów dentystycznych oraz nowoczesnych spieków z trudnotopliwymi metalami - cermetów. Większe zastosowanie znalazł czysty metal, otrzymywany przez elektrolizę stopionych soli lub ich redukcję magnezem.
Metaliczny beryl ma gęstość mniejszą niż aluminium, najwyższą temperaturę topnienia wśród metali lekkich, bardzo dobre własności mechaniczne oraz dość dużą odporność na korozję. Te cechy czynią z niego doskonały materiał konstrukcyjny dla lotnictwa i przemysłu kosmicznego. Nawet niewielki dodatek berylu znacznie polepsza właściwości stopów innych metali. Najczęściej stosowane są stopy berylu z miedzią oraz niklem. Te ostatnie wykazują wytrzymałość na zmęczenie i odporność na korozję większą niż najlepsza stal (produkuje się z nich sprężyny i narzędzia chirurgiczne).
Stopy z miedzią - brązy berylowe - są bardzo twarde i nie iskrzą przy uderzeniu (5). Znalazły zastosowanie w kopalniach, gazowniach, wytwórniach materiałów wybuchowych, czyli wszędzie tam, gdzie iskra mogłaby spowodować katastrofę. Śladowa domieszka berylu w miedzi znacznie zwiększa jej przewodnictwo elektryczne, co umożliwia produkcję kabli o mniejszym przekroju.
Metaliczny beryl to również cenny materiał dla techniki jądrowej. Metal ten jest jednym z pierwiastków najlepiej pochłaniających cząstki alfa (jądra helu-4). W zachodzącej przemianie powstają neutrony, co umożliwiło odkrycie tych cząstek elementarnych (James Chadwick w 1932 roku). Ampułki z proszkiem berylowym zmieszanym z preparatem alfa-promieniotwórczym stosowano w latach 30. ubiegłego wieku jako źródła neutronów, dzięki którym dokonano wielu odkryć, np. sztucznej promieniotwórczości i rozszczepienia jądra atomowego.
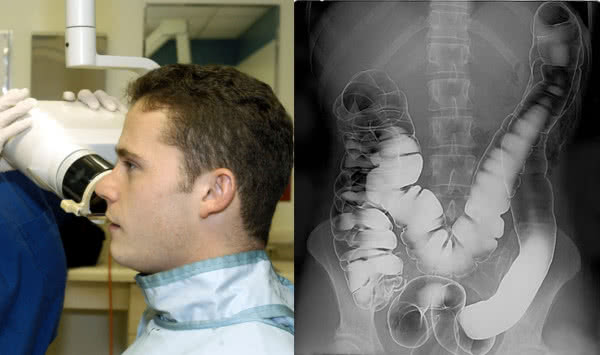
Beryl bardzo słabo pochłania neutrony i jest stosowany w technice jądrowej i bombach atomowych w roli moderatora (spowalnia neutrony) i reflektora (odbija je). Mała liczba atomowa berylu powoduje, że praktycznie nie pochłania on promieniowania rentgenowskiego, co umożliwia jego zastosowanie w aparaturze jako okienko przepuszczające promienie X (6).
a siarczan baru jako kontrast przy prześwietleniu
Bliscy krewni
Z berylem nie wykonasz doświadczeń z powodu trujących właściwości i braku dostępnych związków. Nic jednak nie szkodzi, nie daje on efektownych, barwnych reakcji. Bardziej "kolorowe" są cięższe berylowce, a dziś jeszcze skrótowo o podobnych do siebie stroncie i barze.
Stront został odkryty w minerale znalezionym w pobliżu szkockiej miejscowości Strontian. Identyfikacji nieznanej ziemi dokonał po kilku latach badań lekarz Adair Crawford w roku 1790. Bar ma dłuższą historię. W XVII wieku znaleziono minerał, który po wyprażeniu z węglem dawał fosforyzującą w ciemności substancję (zwano go kamieniem bolońskim). Efekt był wynikiem redukcji siarczanu baru BaSO4 (składnika minerału) do siarczku BaS, który ma zdolność fosforescencji po wystawieniu na światło słoneczne (analogicznie zachowuje się siarczek strontu). Szwedzki chemik Karl Wilhelm Scheele w roku 1774 podczas analizy minerału wyróżniającego się dużym ciężarem właściwym stwierdził w nim obecność nowego pierwiastka - baru. Metale z ich ziem (zwanych strontianą i barytą) wyodrębnił w roku 1808 sir Humphry Davy. Zastosował elektrolizę zwilżonych wodą tlenków: stront i bar rozpuszczały się w stanowiącej katodę rtęci, skąd - po odparowaniu srebrzystej cieczy - można je było wydzielić.
Metoda Davy’ego jest oczywiście nie do zastosowania w warunkach domowych! Otrzymane w ten sposób metale miały jednak domieszkę rtęci, na czyste próbki przyszło poczekać jeszcze wiele lat. Nazwa strontu pochodzi od miejsca odkrycia, natomiast baru od dużej gęstości jego związków (z gr. barys = ciężki).
Metaliczny stront i bar stosowane są jako składniki stopów, a ich siarczany i węglany jako białe pigmenty. Stront nie jest trujący, ale nie pełni również żadnej roli biologicznej. Pewnym zagrożeniem jest izotop stront-90 będący produktem rozszczepienia jąder uranu. Wbudowuje się w kości w miejsce wapnia i wywołuje nowotwory. Bar jest trujący, ale tylko w postaci rozpuszczalnych związków. Praktycznie nierozpuszczalny siarczan stosuje się jako wlew kontrastowy przy prześwietleniach. Bar - pierwiastek o dużej masie atomowej - silnie pochłania promienie RTG, co umożliwia wykonanie zdjęć, np. jelit.
Związki strontu i baru są białe, o ile anion jest bezbarwny. Jednak w wysokiej temperaturze świecą kolorowo. W ogniu palnika gazowego ogrzewaj stalowy drucik do chwili, gdy przestanie barwić płomień. Następnie dotknij nim dowolnej soli strontu lub baru. Gdy do końca przyklei się ziarenko (możesz zwilżyć drucik wodą destylowaną), wprowadź próbkę do płomienia. W przypadku strontu zauważysz karmazynowoczerwoną, a baru zielonożółtą barwę płomienia. Kolorowy efekt wykorzystuje się do produkcji ogni sztucznych (7).
Krzysztof Orliński