Szarlotka z lodami

Tytuł artykułu na pierwszy rzut oka wydaje się mało "chemiczny", jednak kuchnia to wbrew pozorom świetne miejsce dla domowego eksperymentowania, a i produkty żywnościowe są wdzięcznym obiektem doświadczeń. Wracając zaś do szarlotki z lodami, aromat zimnemu deserowi często nadaje…
…wanilia
Ten dodatek do lodów i innych deserów to owoce wanilii płaskolistnej, tropikalnego pnącza z rodziny storczyków (czyli jest ona kuzynką ozdobnych orchidei). Aż do odkrycia Ameryki przyprawa znana była tylko mieszkańcom środkowej i południowej części kontynentu. Hiszpańskim konkwistadorom smakował napój, którym ich poczęstowali Aztekowie (była to czekolada z wanilią), przywieźli więc przyprawę do swojego kraju, skąd rozpowszechniła się w pozostałej części Europy. Obecnie wanilię znajdziemy na plantacjach w strefie tropikalnej całego świata, a największym producentem jest Madagaskar (1).
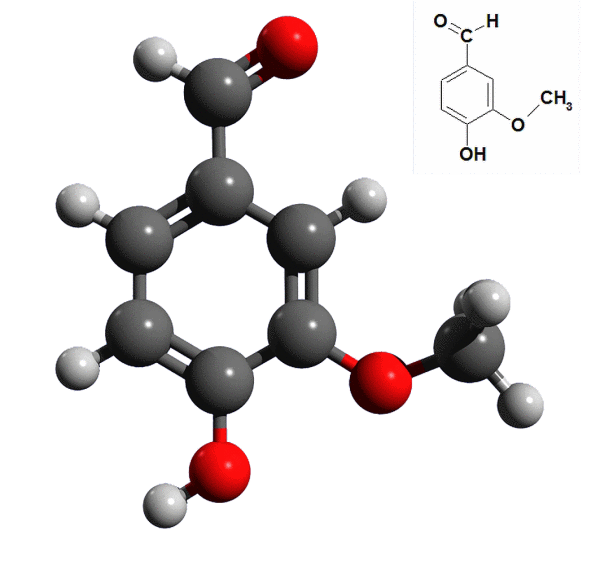
W połowie XIX wieku z naturalnej wanilii wyizolowano jej główny składnik - aldehyd wanilinowy, zwany waniliną. Pamiętaj jednak, że w wanilii występuje około 300 lotnych związków i to dopiero ich mieszanina nadaje charakterystyczny zapach. W przypadku innych przypraw sytuacja jest analogiczna.
Już w drugiej połowie XIX wieku pomyślano o produkcji syntetycznego aromatu wanilii, aby uniezależnić się od nieprzewidywalnych kaprysów pogody i monopolu plantatorów. Początkowo produkcja była kosztowna, ale znalezienie odpowiedniego surowca sprawiło, że sam aromat okazał się znacznie tańszy od naturalnego. Z tego też powodu wanilina produkowana jest na wielką skalę (zapotrzebowanie zgłasza przemysł spożywczy i kosmetyczny), a jej zapach praktycznie nie różni się od oryginalnego ekstraktu z wanilii. Surowcem do wytwarzania waniliny okazały się odpadki po produkcji papieru. Obecnie, ze względów ochrony środowiska, wanilinę wytwarza się z gwajakolu (stosowany m.in. jako środek wykrztuśny), choć ostatnio pojawiło się i inne źródło…
Analiza struktury cząsteczki waniliny pozwala stwierdzić, że jest to aromatyczny (ma pierścień benzenowy) aldehyd (grupa -CHO) z dodatkowymi grupami funkcyjnymi związanymi z pierścieniem. Taka budowa molekuły umożliwi ci przeprowadzenie kilku prób (2).
Z wanilią i waniliną związane są nazewnicze nieścisłości. Popularny cukier waniliowy to cukier aromatyzowany kawałkami naturalnej wanilii, cukier wanilinowy to z kolei cukier, któremu zapach nadaje syntetyczna wanilina. Zamiast tej ostatniej często stosowana jest etylowanilina, pochodna waniliny, w której zamiast grupy metylowej (-CH3) znajduje się grupa etylowa (-CH2-CH3). Związek ten ma kilkakrotnie silniejszy aromat niż wanilina. Podobnie wygląda sprawa z olejkami zapachowymi do ciast: są i waniliowe (droższe), i wanilinowe.
W roku 2007 humorystyczną nagrodę IgNobla w dziedzinie chemii otrzymała japońska badaczka Mayu Yamamoto, która wraz z zespołem opracowała metodę produkcji syntetycznej waniliny z… krowich "placków". Na uroczystości wręczenia nagród podawano lody aromatyzowane "krowią" waniliną, które wszystkim smakowały. Część gości nie została jednak poinformowana o pochodzeniu waniliny, co tylko potwierdza starą prawdę, że nie należy zaglądać do kuchni i wnikać w szczegóły przygotowywania potraw, jeśli nie chce się stracić apetytu.
Lody mogą być aromatyzowane różnymi zapachami, ale w przypadku szarlotki wybór jest tylko jeden…
…cynamon
To z kolei jasnobrązowej barwy kora cynamonowca o charakterystycznym słodkawym zapachu. Drzewo cynamonowe pierwotnie rosło na Cejlonie, w Indiach i Chinach, obecnie jest uprawiane na plantacjach również w innych częściach świata. Cynamon to jedna z przypraw używanych od najdawniejszych czasów, chętnie dodawany do potraw z jabłek i ryżu.
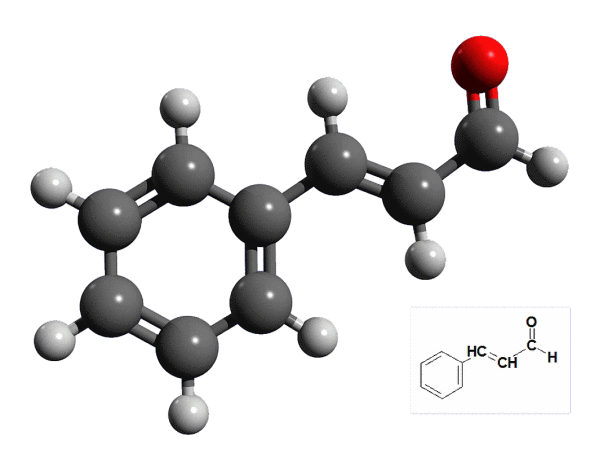
Do Europy trafił w początkach XVI wieku za sprawą Portugalczyków eksplorujących kraje Dalekiego Wschodu. Przyprawy używa się w postaci całych lub sproszkowanych kawałków kory oraz olejku otrzymywanego przez destylację kory z parą wodną. Głównym składnikiem ekstraktu jest aldehyd cynamonowy (ok. 80% zawartości). Podobnie jak w przypadku naturalnej wanilii, na bukiet zapachowy wpływają również pozostałe jego składniki. Oprócz pozyskiwania ze źródeł naturalnych, aldehyd cynamonowy otrzymuje się także syntetycznie, a stosuje szeroko do aromatyzowania produktów spożywczych i jako składnik środków zapachowych (3).
Aldehyd cynamonowy to związek aromatyczny z grupą aldehydową przyłączoną do wiązania podwójnego. Wzór związku nie jest napisany dowolnie: pierścień benzenowy i grupa aldehydowa znajdują się po przeciwnych stronach linii poprowadzonej wzdłuż wiązania podwójnego. Taki układ grup nazywa się położeniem trans, gdy zaś grupy leżą po tej samej stronie - położenie określa się jako cis (wymawiaj jak nazwę dźwięku, nie zaś drzewa) (4).
I doświadczenia z nimi
Potrzebne ci będą źródła waniliny i aldehydu cynamonowego. Wizyta w sklepie spożywczym rozwiąże problem odczynników - kup cukier wanilinowy i cynamon w proszku (tak będzie najprościej i najtaniej). Nie martw się, jeżeli w składzie cukru znajduje się etylowanilina - reakcje przebiegną identycznie, jak w przypadku waniliny.
Ze wzoru waniliny wynika, że jest ona także fenolem. Związki tego typu mają charakter kwasowy, choć nie mają grupy karboksylowej -COOH. Dysocjacji w wodzie ulega proton z grupy -OH związanej z pierścieniem benzenowym.
Opakowanie cukru wanilinowego rozpuść w około 10 cm³ wody. Zanurz bagietkę w roztworze i upuść kroplę na papierek wskaźnikowy (roztwór zachowaj, wykorzystasz go w następnych doświadczeniach). Odczyt wykaże pH wynoszące około 4 jednostek. Z popularnych wskaźników barwę w tym zakresie zmienia oranż metylowy. Pobierz około 1 cm³ roztworu, wlej porcję do probówki i dodaj kroplę wskaźnika. Pomarańczowa barwa zawartości potwierdzi oszacowanie wykonane poprzednio (oranż metylowy jest czerwony przy pH poniżej 3,2, żółty przy pH powyżej 4,4; a w zakresie 3,2–4,4 przyjmuje barwę przejściową - pomarańczową) (5).
Fenole dają charakterystyczną reakcję z jonami żelaza(III): powstaje kompleks o ciemnoniebieskiej barwie. Do probówki pobierz 1 cm³ roztworu cukru wanilinowego i dodaj kilka kropli roztworu chlorku żelaza(III) FeCl3. Ciemne zabarwienie zawartości naczynia potwierdzi, że wanilina jest fenolem. Identyczny wynik otrzymasz z roztworem kwasu salicylowego, który również jest fenolem (2% roztwór alkoholowy jest używany jako środek dezynfekcyjny - pytaj o niego w drogeriach i aptekach).
Pora na grupę aldehydową. Do jej identyfikacji posłuży próba Trommera. Oprócz roztworu cukru wanilinowego potrzebne będą: roztwór siarczanu(VI) miedzi(II) CuSO4 oraz wodorotlenku sodu NaOH. Do probówki wlej 1 cm³ roztworu cukru wanilinowego, dodaj do niej kilka kropli roztworu soli miedzi oraz zasady sodowej (powstanie galaretowaty, błękitny osad wodorotlenku miedzi; w reakcji musisz użyć nadmiaru NaOH). Probówkę ostrożnie ogrzej w płomieniu palnika lub - lepiej - wstaw do zlewki z gorącą wodą. Ceglastoczerwone zabarwienie w probówce to dowód na obecność grupy aldehydowej (R w zapisie oznacza nieulegający zmianie fragment cząsteczki waniliny):
R-CHO+2Cu(OH)2 + OH- → R-COO- +Cu2O + 3H2O
Barwę zawartości nadaje osad tlenku miedzi(I) Cu2O, natomiast wanilina przekształca się w kwas wanilinowy (ściślej w zasadowym środowisku reakcji powstaje jego sól sodowa), który również występuje w naturalnej wanilii i także ją aromatyzuje.
Możesz mieć obawy, czy pozytywny wynik doświadczenia nie jest efektem obecności cukru w roztworze. Sacharoza składa się z glukozy i fruktozy, a przecież oba te cukry proste również redukują odczynnik Trommera. W celu rozwiania wątpliwości przeprowadź ślepą próbę. Polega ona na wykonaniu reakcji zgodnie z przepisem, ale wśród reagentów brak jest szukanego składnika. Tym sposobem można wykryć ewentualne domieszki fałszujące wynik eksperymentu.
W 10 cm³ wody rozpuść łyżeczkę zwykłego cukru, pobierz próbkę i tak jak poprzednio dodaj do niej roztwory CuSO4 oraz NaOH. Próbówkę ogrzej w gorącej wodzie. Tym razem wynik próby jest negatywny - powstaje czarny osad tlenku miedzi(II) CuO (z rozkładu wodorotlenku) lub też szafirowo zabarwiony kompleks miedzi z sacharozą. Cukier stołowy nie redukuje wodorotlenku miedzi, ponieważ w warunkach reakcji nie rozpada się na składniki. Zatem ceglasty osad rzeczywiście tworzy się w obecności aldehydu wanilinowego w roztworze (6).
- pozytywny, czarny - negatywny
W aldehydzie cynamonowym wykryjesz wiązanie podwójne za pomocą wody bromowej, czyli roztworu bromu. Ten nietrwały i szkodliwy odczynnik wykonaj bezpośrednio przed reakcją i od razu zużyj do doświadczenia. Potrzebny ci będzie bromek potasu KBr oraz roztwory kwasu siarkowego(VI) H2SO4 i nadtlenku wodoru H2O2 (np. woda utleniona, czyli 3% roztwór). Szczyptę KBr rozpuść w wodzie, dodaj kilka kropli roztworu kwasu i porcję wody utlenionej. Mieszanina od razu przybiera żółtawe zabarwienie pochodzące od wolnego bromu. Otrzymana w ten sposób woda bromowa jest zanieczyszczona resztką KBr oraz jonami siarczanowymi, ale nie wpływa to na jej właściwości. Domieszka H2O2 może przeszkadzać, ale gdy nie użyłeś jej nadmiaru - całość uległa rozkładowi. W przeciwnym razie do probówki wsyp szczyptę dwutlenku manganu MnO2 (związek wchodzi w skład ciemnej masy zawartej w jednorazowych ogniwach Leclanchégo). Po reakcji pozwól osadowi opaść na dno i zlej roztwór bromu.
Do probówki z kilkoma cm³ wody bromowej wsyp ćwierć łyżeczki cynamonu i energicznie wstrząsaj zawartość przez około 30 sekund. Odstaw probówkę, a gdy osad opadnie na dno, zauważysz, że woda bromowa uległa odbarwieniu. To dowód na obecność wiązania podwójnego w aldehydzie cynamonowym (brom został zużyty do reakcji) (7).
Pozostawiam ci udowodnienie istnienia grupy aldehydowej w badanym związku. Do tego celu wykorzystaj próbę Trommera. Szczyptę cynamonu zmieszaj z kilkoma cm³ wody, dobrze wytrząśnij, a dalej postępuj jak w przypadku doświadczenia z waniliną.
Na dziś to już wszystko. Mimo tytułu, który nie zwiastował nic "chemicznego", udało się przeprowadzić kilka ciekawych eksperymentów. Trzeba przyznać, że chemik zawsze, nawet podczas słodkiej przekąski, znajdzie coś interesującego ze swej dziedziny.
Krzysztof Orliński