Karbin - jednowymiarowy węgiel
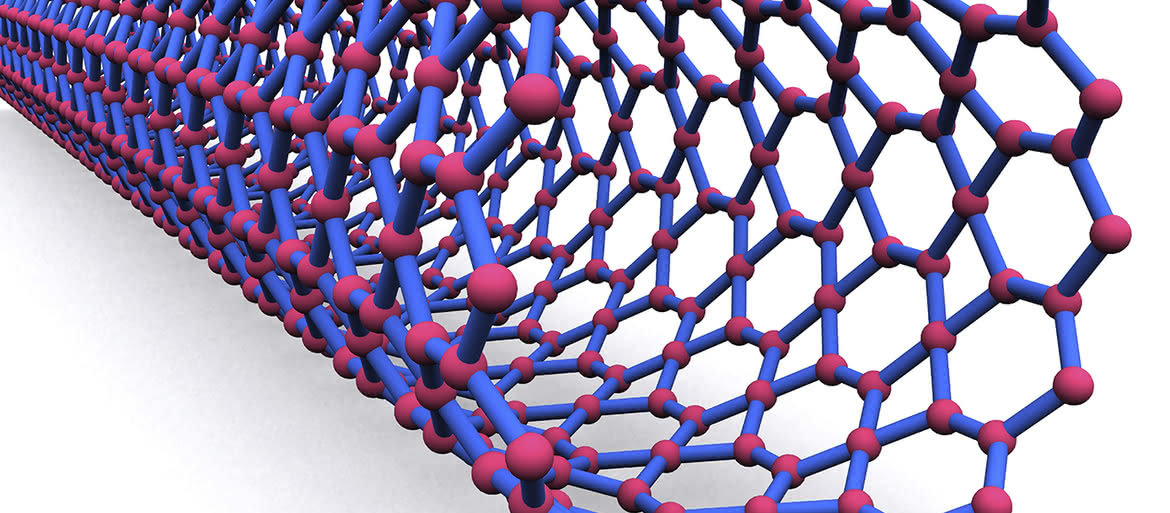
Grafen, uznawany wciąż za wielką nadzieję i zwiastuna rewolucji materiałowej, zanim na dobre zagościł w technice, już może zostać zdetronizowany przez swojego węglowego krewniaka - karbin. Obliczenia wykazały, że karbin ma dwukrotnie większą wytrzymałość na rozciąganie niż grafen, a jego sztywność rozciągania pozostaje trzykrotnie większa niż diamentu. Karbin jest (teoretycznie) stabilny w temperaturze pokojowej, a gdy jego nici przechowywane są razem, krzyżują się w sposób przewidywalny.
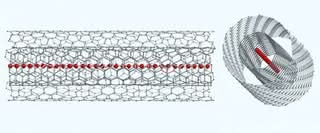
Mówimy o alotropowej odmianie węgla o strukturze polialkinu (C≡C)n, w której atomy tworzą długie łańcuchy o występujących naprzemiennie pojedynczych i potrójnych wiązaniach lub skumulowanych wiązaniach podwójnych. Taki układ nazywany jest strukturą jednowymiarową (1D), gdyż nic innego nie jest dołączone do nici grubości pojedynczego atomu. Struktura grafenu pozostaje dwuwymiarowa, ponieważ ma długość i szerokość, ale grubość płachty wynosi tylko jeden atom. Dotychczas przeprowadzone badania sugerują, że najbardziej wytrzymałą formą karbinu byłyby dwie splątane ze sobą nici (1).
Do niedawna o karbinie wiadomo było niewiele. Astronomowie podają, że pierwszy raz wykryto go w meteorytach i pyle międzygwiezdnym.
Mingjie Liu wraz z zespołem z Uniwersytetu Rice obliczyli teoretyczne właściwości karbinu, które mogą pomóc podczas badań empirycznych. Badacze przedstawili analizę z uwzględnieniem badań wytrzymałości na rozciąganie, zginanie i odkształcenia skrętne. Wyliczyli, że wytrzymałość właściwa karbinu (czyli wytrzymałość w stosunku do masy) jest na niespotykanym poziomie (6,0-7,5 × 107 N∙m/kg) – w porównaniu do grafenu (4,7-5,5 × 107 N∙m/kg), nanorurek węglowych (4,3-5,0 × 107 N∙m/kg) oraz diamentu (2,5-6,5 × 107 N∙m/kg). Zerwanie pojedynczego wiązania w łańcuchu atomowym wymaga użycia siły o wartości ok. 10 nN. Długość łańcucha w temperaturze pokojowej wynosi ok. 14 nm.
Przez dodanie grupy funkcyjnej CH2 na końcu łańcucha karbin może zostać skręcony podobnie jak nici DNA. Przez „dekorowanie” łańcuchów karbinu różnymi cząsteczkami, można modyfikować inne właściwości. Dodanie pewnych atomów wapnia, które łączą się z atomami wodoru, spowoduje powstanie gąbki o wysokiej gęstości do magazynowania wodoru.
Ciekawą właściwością nowego materiału jest zdolność tworzenia wiązań z bocznymi łańcuchami. Proces powstawania i rozrywania tych wiązań może zostać wykorzystany do przechowywania i uwalniania energii. Tym samym karbin mógłby posłużyć jako bardzo efektywny materiał do przechowywania energii, gdyż jego molekuły mają średnicę pojedynczego atomu, a wytrzymałość materiału sugeruje, że możliwe będzie wielokrotne tworzenie i rozrywanie wiązań bez ryzyka rozpadu samej molekuły.
Wszystko wskazuje na to, że rozciąganie czy skręcanie karbinu zmienia jego właściwości elektryczne. Teoretycy zaproponowali nawet umieszczenie na końcach molekuły specjalnych „uchwytów”, które pozwoliłyby na szybkie i łatwe zmienianie przewodnictwa czy szerokości pasma wzbronionego karbinu.
Niestety, wszystkie znane i jeszcze nieodkryte właściwości karbinu pozostaną jedynie miłą teorią, jeśli materiału nie będziemy potrafili tanio i masowo produkować. Niektóre laboratoria naukowe donosiły o uzyskaniu karbinu, jednak materiał okazywał się niezwykle niestabilny. Część chemików uważa też, że jeśli zetkniemy ze sobą dwie nici karbinu, dojdzie do eksplozji. W kwietniu tego roku pojawiły się doniesienia o opracowaniu stabilnego karbinu w postaci nici wewnątrz „ścian” ze struktury grafenowej (2).
Być może wspomniana na początku technika z Uniwersytetu Wiedeńskiego oznacza przełom. Powinniśmy się wkrótce przekonać.