Związki kompleksowe żelaza

Pierwszy eksperyment pozwoli zaobserwować zmiany barwy roztworu zachodzące podczas tworzenia fluorkowego kompleksu jonów żelaza(III). Do przeprowadzenia próby potrzebne będą roztwory fluorku sodu NaF i chlorku żelaza(III) FeCl3 (fotografia 1). Roztwór soli żelaza ma żółtoczerwone zabarwienie pochodzące od uwodnionych jonów tego metalu ![]() , w skrócie zapisywanych również jako
, w skrócie zapisywanych również jako ![]() . Po zmieszaniu cieczy znika zabarwienie w kolbie zawierającej roztwór FeCl3 (fotografia 2). Za efekt próby odpowiada tworzenie (pod wpływem dużego stężenia jonów fluorkowych) bezbarwnego kompleksu fluorkowego ? jonów heksafluorożelaza(III):
. Po zmieszaniu cieczy znika zabarwienie w kolbie zawierającej roztwór FeCl3 (fotografia 2). Za efekt próby odpowiada tworzenie (pod wpływem dużego stężenia jonów fluorkowych) bezbarwnego kompleksu fluorkowego ? jonów heksafluorożelaza(III):
Przemianę zapisano schematycznie z pominięciem cząsteczek wody (nad strzałką znajduje się wzór substancji, którą działamy na akwakompleks). Fotografia 3 przedstawia barwy połączeń kompleksowych jonów żelaza(III) biorących udział w doświadczeniu.
W kolejnej próbie otrzymamy związek, w którym żelazo występuje zarówno w postaci kationu, jak i anionu. Do wykonania eksperymentu potrzebne będą roztwory siarczanu(VI) żelaza(II) FeSO4 oraz cyjanożelazianu(III) potasu K3[Fe(CN)6] (zwanego również żelazicyjankiem potasu) (fotografia 4). Po zmieszaniu obu roztworów zawartość kolby przyjmuje ciemnoniebieskie zabarwienie pochodzące od tworzącego się kompleksu ? błękitu Turnbulla (fotografia 5):
![]()
Podobnym do użytego w poprzedniej próbie żelazicyjanku jest cyjanożelazian(II) potasu K4[Fe(CN)6], zwany także żelazocyjankiem potasu. Jego roztwór wraz z roztworem chlorku żelaza(III) FeCl3 pozwoli wykonać następne doświadczenie (fotografia 6). Po zmieszaniu obu cieczy także w tym przypadku zawartość kolby staje się ciemnoniebieska. Za efekt eksperymentu odpowiada tworzenie pigmentu ? błękitu pruskiego (fotografia 7):
Podane wzory otrzymanych połączeń kompleksowych nie są ścisłe, badania struktury obu związków wskazują, że w ich skład wchodzą także jony potasu. Ponadto jony żelaza znajdujące się w postaci kationu oraz kompleksowego anionu ulegają redukcji i utlenianiu, w konsekwencji zmieniając skład związków.
W kolejnym eksperymencie otrzymamy kompleks żelaza(III) z anionami rodankowymi (tiocyjanianowymi). Do przeprowadzenia próby potrzebne będą roztwory chlorku żelaza(III) FeCl3 oraz rodanku potasu KNCS (fotografia 8). Do probówki z wodnym roztworem soli żelaza(III) dodajemy kilka kropli roztworu rodanku potasu, co powoduje natychmiastową zmianę zabarwienia z żółtego na krwistoczerwone (fotografia 9). Intensywny kolor spowodowany jest powstaniem związku kompleksowego:
![]()
W rzeczywistości tworzy się cały szereg kompleksów o wzorach od ![]() do
do ![]() (barwa pogłębia się ze wzrostem liczby przyłączonych jonów rodankowych).
(barwa pogłębia się ze wzrostem liczby przyłączonych jonów rodankowych).
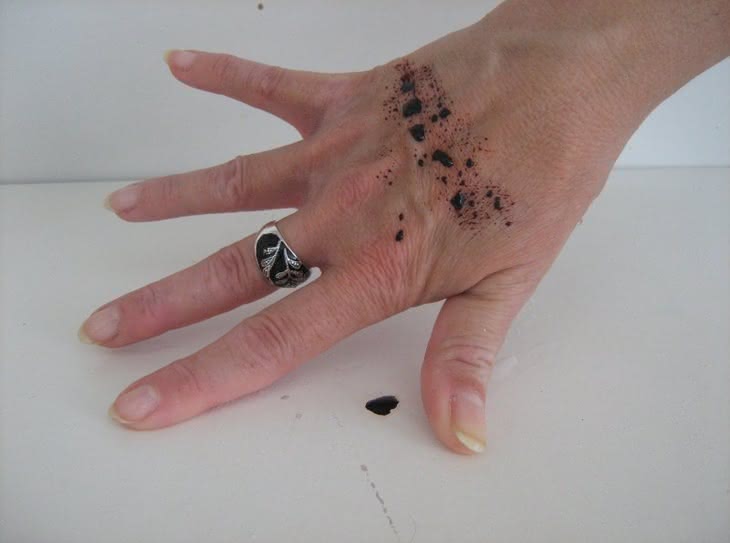
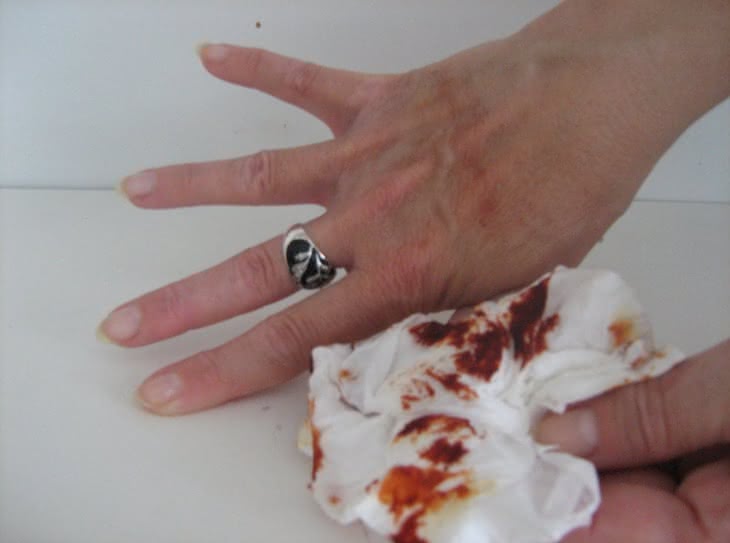
Reakcję otrzymywania rodankowego kompleksu żelaza(III) wykorzystamy do następnego, nieco ?makabrycznego? doświadczenia, znanego jako ?chemiczna krew?. Eksperyment rozpoczynamy do posmarowania ostrza noża roztworem FeCl3 (fotografia 10), a skóry dłoni ? roztworem KNCS (fotografia 11). Po ostrożnym przyłożeniu noża do ręki na powierzchni skóry tworzy się krwistoczerwony kompleks (fotografia 12), doskonale imitujący krew (fotografia 13). Wystarczy jednak użyć chusteczki higienicznej, aby usunąć ślady ?zranienia? (fotografia 14). Przeprowadzona reakcja wykorzystywana jest jako efekt specjalny w kinematografii.
Następny artykuł o związkach kompleksowych żelazach znajdziesz w kwietniowym numerze magazynu Młody Technik