Związki kompleksowe część VI - Kompleksy chelatowe
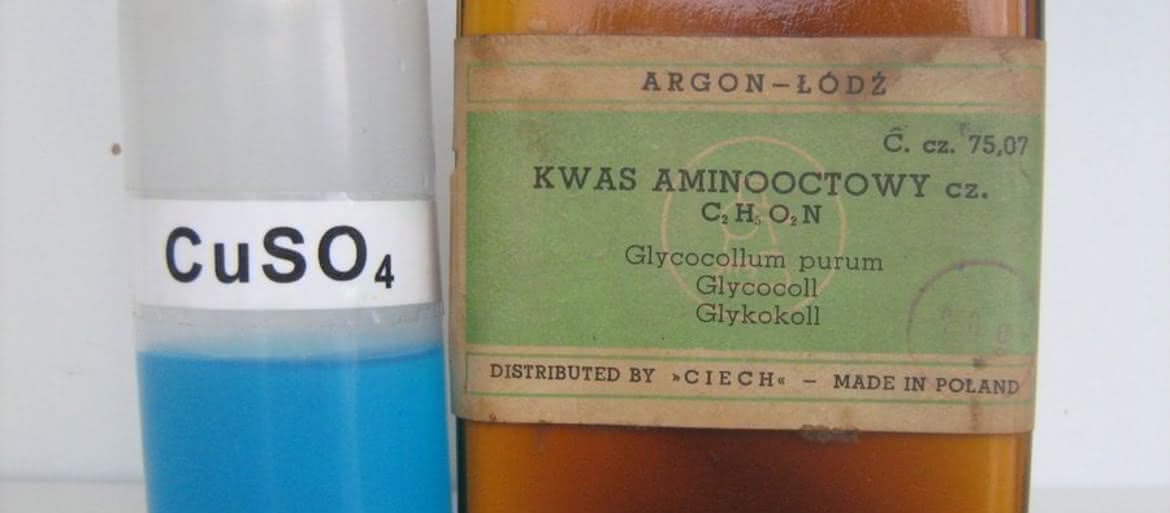
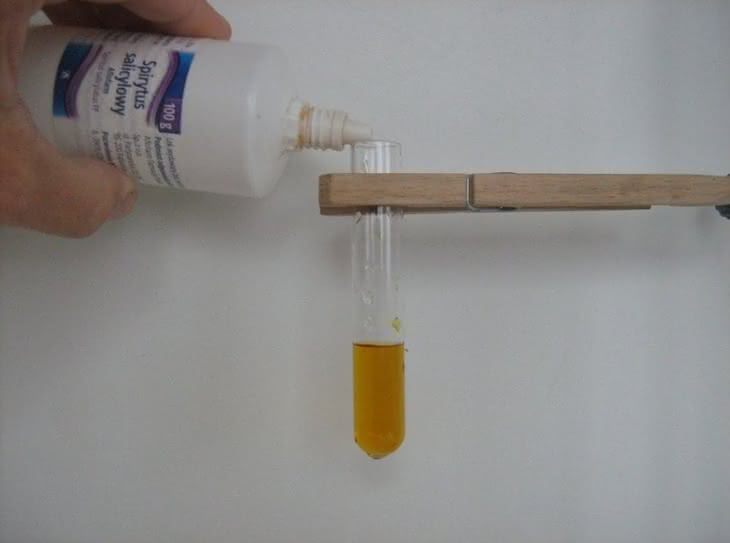
W pierwszym eksperymencie przeprowadzimy reakcję pomiędzy jonami miedzi(II) i kwasem aminooctowym (glicyną, jednym z aminokwasów białkowych). Do wykonania próby potrzebne będą roztwory siarczanu miedzi CuSO4 oraz glicyny H2N-CH2-COOH (fotografia 1). Do probówki nalewamy niewielką objętość błękitnego roztworu soli miedzi, a następnie dodajemy nieco roztworu kwasu aminooctowego (fotografia 2). Zawartość naczynia zmienia barwę na lazurową. Zjawisko spowodowane jest utworzeniem chelatowego kompleksu jonów miedzi(II) z anionami glicyny:
Barwy obu połączeń widoczne są na fotografii 3: z lewej – akwakompleksu, z prawej – kompleksu z glicyną.W drugiej próbie otrzymamy kompleks jonów żelaza(III) z kwasem salicylowym. Do wykonania doświadczenia potrzebne będą wodne roztwory chlorku żelaza(III) FeCl3 oraz kwasu salicylowego C6H4(OH)COOH. Zamiast czystego odczynnika organicznego można użyć spirytusu salicylowego – dostępnego w każdej aptece środka odkażającego, który jest 1% alkoholowym roztworem tego kwasu (fotografia 4). Do probówki nalewamy nieco żółtoczerwonego roztworu FeCl3, a następnie dodajemy kilka kropli spirytusu salicylowego (fotografia 5). Zawartość naczynia zmienia zabarwienie na niebieskofioletowe, pochodzące od utworzonego połączenia chelatowego:
Ciecz w probówce barwą przypomina atrament. Nic w tym dziwnego – atramenty są wytwarzane ze związków o budowie zbliżonej do kwasu salicylowego. Przeprowadzona reakcja jest charakterystyczną próbą pozwalającą wykryć fenole – związki z grupą OH połączoną z pierścieniem benzenowym (to ugrupowanie jest obecne również w cząsteczce kwasu salicylowego). Fotografia 6 przedstawia barwy obu związków: z lewej strony – akwakompleksu, z prawej - chelatu.Jednym z zastosowań ligandów wielokleszczowych jest oznaczanie zawartości kationów metali w roztworach. Metodą analityczną jest miareczkowanie, polegające na dodawaniu do badanej próbki roztworu substancji z nią reagującej (o znanym stężeniu). Koniec miareczkowania sygnalizowany jest najczęściej zmianą zabarwienia odpowiednio dobranego wskaźnika. Znając objętość zużytego roztworu miareczkującego, możemy wyliczyć zawartość oznaczanego kationu w próbce.
Do przeprowadzenia miareczkowania jonów wapnia w wodzie z kranu użyjemy roztworu EDTA (sól sodowa kwasu wersenowego), wskaźnika o handlowej nazwie „Calmagite” oraz wody amoniakalnej (fotografia 7). Doświadczenie rozpoczynamy od dodania kropli wodnego roztworu amoniaku do odmierzonej objętości wody z kranu (fotografia 8), co ma na celu zapewnienie alkalicznego środowiska reakcji (prawidłowe wykonanie próby wymaga pH wynoszącego ok. 10).
Teraz do zlewki dodajemy kroplę roztworu wskaźnika (fotografia 9), barwiącą zawartość naczynia na czerwono. Następnie nabieramy do małej pipety roztwór EDTA i kroplami wlewamy go do naczynia z próbką (fotografia 10). Po dodaniu każdej kropli mieszamy zawartość, potrząsając zlewką. Koniec miareczkowania sygnalizuje raptowna zmiana barwy roztworu na niebieską (fotografia 11).
EDTA tworzy z jonami wapnia połączenie chelatowe o następującej strukturze: