Fenoloftaleina

W pierwszej próbie sprawdzimy zachowanie wskaźnika w roztworach o zróżnicowanym pH. Potrzebne odczynniki to: alkoholowy roztwór fenoloftaleiny o stężeniu 1%, ok. 30% roztwór kwasu siarkowego(VI) H2SO4 (handlowy roztwór rozcieńczyć wodą w stosunku 1:2), ok. 30% roztwór wodorotlenku sodu NaOH. Doświadczenie rozpoczynamy od umieszczenia w probówce kilku cm3 roztworu H2SO4. Kropla roztworu wskaźnika wprowadzona do probówki powoduje zabarwienie zawartości na pomarańczowo. Po dodaniu niewielkiej ilości wody barwa znika (fotografia 1). Do następnej probówki wlewamy kilka cm3 wody i dodajemy kroplę roztworu NaOH, a następnie kroplę roztworu wskaźnika – tym razem fenoloftaleina zachowuje się „poprawnie” i barwi zawartość naczynia na malinowo (fotografia 2). W kolejnej części eksperymentu do probówki wlewamy kilka cm3 stężonego roztworu zasady i dodajemy kroplę roztworu wskaźnika. Początkowe zabarwienie szybko znika. Jeśli teraz dodamy niewielką ilość roztworu kwasu, pojawi się malinowa barwa (fotografia 3).
Reakcje, które odpowiadają za efekty wykonanych prób, są następujące:
1. W silnie kwaśnym roztworze (pH<0) bezbarwna forma fenoloftaleiny ulega przemianie do karbokationu o pomarańczowym zabarwieniu:
Reakcja jest odwracalna i po rozcieńczeniu wodą (spadek zakwaszenia, czyli wzrost pH) ponownie odtwarza się bezbarwna postać wskaźnika.
2. „Normalne” zachowanie fenoloftaleiny w roztworze o odczynie zasadowym (pH>8,2) polega na wytworzeniu tzw. sprzężonego układu wiązań podwójnych obejmującego całą cząsteczkę. Odpowiada on za intensywne zabarwienie tej formy wskaźnika:
Oczywiście zakwaszenie środowiska (pH<8,2) powoduje zanik barwy.
3. W środowisku silnie zasadowym (pH>12) zabarwiona postać fenoloftaleiny przechodzi w formę bezbarwną (zniszczeniu ulega układ sprzężonych wiązań podwójnych całej molekuły):
Reakcja jest odwracalna i zakwaszenie środowiska przywraca zawartości próbki malinowe zabarwienie. Wszystkie otrzymane formy fenoloftaleiny widoczne są na fotografii 4.
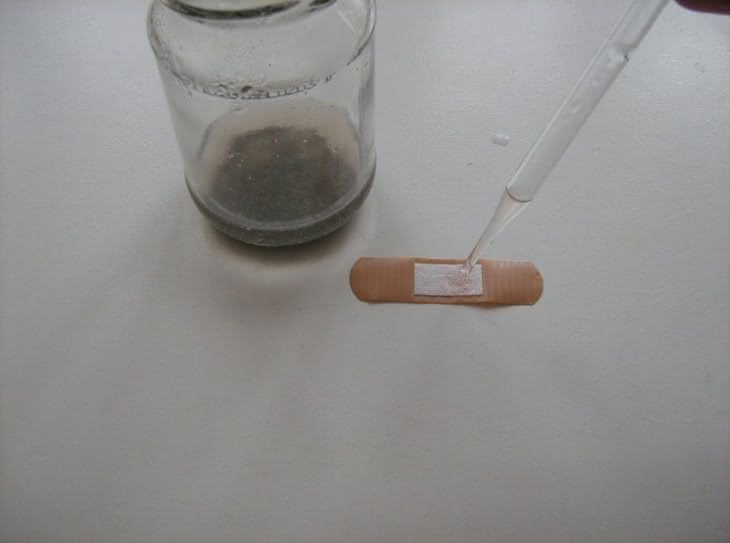
Fenoloftaleina jest używana jako składnik odczynnika służącego do wykrywania śladów krwi. Postępowanie analityczne nosi nazwę testu Kastle-Meyera. Do sporządzenia reagenta potrzebne będą: wodorotlenek potasu KOH, fenoloftaleina oraz opiłki lub pył cynkowy. Do słoiczka wlewamy kilkanaście cm3 wody, wsypujemy kilka granulek wodorotlenku, pył cynkowy oraz odrobinę fenoloftaleiny. Naczynie zakręcamy, wstawiamy do garnka z wodą i zaczynamy ogrzewanie na łaźni wodnej (co pewien czas uchylamy zakrętkę w celu wyrównania ciśnień). Po 0,5-1 godzinie zawartość naczynia zmienia barwę z intensywnie malinowej na żółtawą (fotografia 5). Jest to oznaka końca reakcji – cynk zredukował wskaźnik do związku zwanego fenoloftaliną. Gotowy odczynnik Kastle-Meyera przechowujemy w zamykanym naczyniu, w ciemnym miejscu oraz zmieszany z cynkowym pyłem (najwygodniej pozostawić go w słoiku).
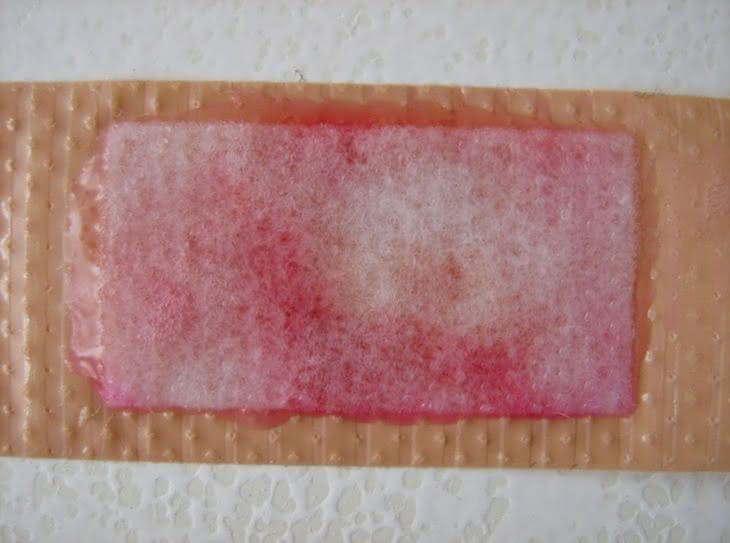
Do wykonania próby potrzebna jest woda utleniona (3% roztwór nadtlenku wodoru H2O2) oraz ślady krwi, np. na opatrunku zdjętym z rany (fotografia 6). Na powierzchnię nanosimy kilka kropli odczynnika (fotografia 7), a następnie taką samą ilość wody utlenionej (fotografia 8). W obecności śladów krwi próbka barwi się na różowo (fotografia 9 i 10). Jest to dodatni wynik testu Kastle-Meyera.
Hemoglobina krwi powoduje rozkład H2O2, a wydzielony tlen utlenia fenoloftalinę do fenoloftaleiny. W zasadowym środowisku reakcji przyjmuje ona charakterystyczne zabarwienie. Jednak barwa musi wystąpić w czasie nie przekraczającym 30 sekund, ponieważ po dłuższej chwili następuje utlenianie fenoloftaliny tlenem z powietrza i pojawienie się zabarwienia analizowanej próbki. W teście przeszkadzają zanieczyszczenia próbki substancjami rozkładającymi wodę utlenioną (np. enzymami pochodzącymi z roślin). Test Kastle-Meyera stosowany jest w badaniach kryminalistycznych.
Obejrzyj nasze filmy: