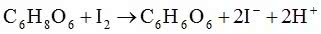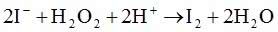Najpopularniejsza witamina - część 2

Przeprowadźmy jeszcze jedno doświadczenie pokazujące, że kwas askorbinowy jest reduktorem (okaże się to ściśle związane z tematyką tego artykułu).
Jodometria
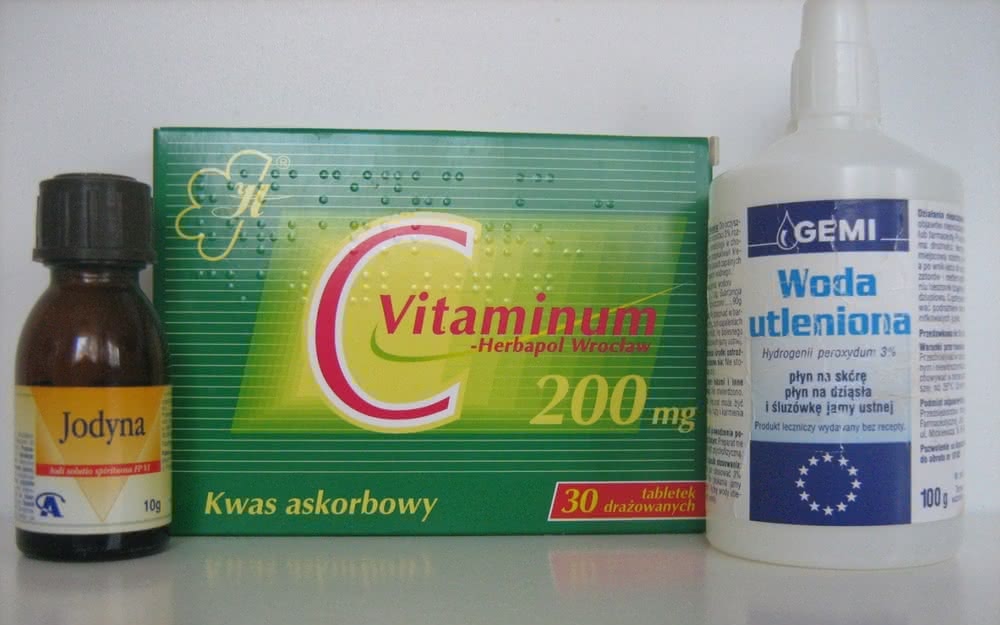
Potrzebny będzie roztwór jodu (np. jodyna – środek dezynfekujący w postaci 3% roztworu jodu w etanolu z 1% dodatkiem jodku potasu) oraz wskaźnik skrobiowy barwiący się na intensywnie niebieski kolor pod wpływem wolnego jodu. Ten ostatni przygotowujemy, rozcierając pół łyżeczki mąki ziemniaczanej z kilkunastoma cm3 zimnej wody. Powstałą papkę przenosimy do 100-200 cm3 wrzącej wody i gotujemy przez kilka minut, cały czas mieszając. Po ostudzeniu roztwór przechowujemy w szczelnie zamkniętym naczyniu w lodówce.
Ponieważ wolny jod pozostawia brunatne plamy na skórze, ubraniu lub blacie stołu, konieczne jest zachowanie ostrożności podczas posługiwania się jego roztworem. Należy zatem chronić skórę rąk (np. przy pomocy rękawic z tworzywa sztucznego dołączonych do farb do włosów) oraz otoczenie (próby wykonujemy na tacy). Same plamy usuniemy przy pomocy roztworu tiosiarczanu sodu Na2S2O3 lub witaminy C.
Pora na eksperyment. Do probówki wlewamy 1 cm3 roztworu kwasu askorbinowego, rozcieńczamy go kilkoma cm3 wody i dodajemy 1 cm3 wskaźnika skrobiowego. Teraz po kropli dodajemy jodynę, mieszając przy tym zawartość naczynia. Wpadające krople jodyny początkowo natychmiast się odbarwiają. Zbliżający się koniec próby poznajemy jednak po coraz dłuższym czasie odbarwiania się roztworu. Gdy kolejna kropla spowoduje trwałe zabarwienie zawartości probówki, witamina C zostaje w całości utleniona (1).
Przebiegającą reakcję zapisujemy równaniem (wzory w postaci sumarycznej):
Dalsze postępowanie będzie uzależnione od posiadanego sprzętu laboratoryjnego. Spróbujemy ilościowo oznaczyć zawartość kwasu askorbinowego w próbkach, w celu stwierdzenia wpływu różnych czynników na niszczenie witaminy C. Oznaczenia wykonamy przy pomocy analizy miareczkowej, stosując roztwór jodu o znanym stężeniu. Gdy dysponujemy prawdziwym zestawem do miareczkowania, składającym się z biurety, kolby miarowej i pipety (lub mamy do niego dostęp, np. na zajęciach koła chemicznego w szkole), nasze wyniki powinny być bardzo dokładne (2).W warunkach domowych całkiem dobre rezultaty zapewni również sama pipeta. Jeśli nie mamy i tego, pozostaje prosta metoda polegająca na liczeniu kropli zużytego roztworu jodyny (używamy zwykłego zakraplacza). Miejmy jednak świadomość, że kluczowym dla dokładności oznaczenia czynnikiem jest utrzymanie identycznej wielkości kropel (choć wyniki i tak prawdopodobnie będą obarczone dosyć dużym błędem).
Miareczkowanie rozpoczynamy od ustalenia tzw. miana roztworu jodu, czyli po prostu jego stężenia w posiadanym roztworze. W naszym przypadku będzie to ilość witaminy C (w mg), która reaguje z określoną objętością roztworu. Przygotowujemy roztwór kwasu askorbinowego. Tabletkę o zawartości 100 mg dokładnie proszkujemy i rozpuszczamy w 100 cm3 wody (dokładnie odmierzonej). W ten sposób dysponujemy roztworem, który w 1 cm3 zawiera 1 mg witaminy C. Pobieramy próbkę o objętości 5 cm3 (również dokładnie odmierzoną), rozcieńczamy ją w kolbie kilkunastoma cm3 wody i dodajemy pół łyżeczki wskaźnika skrobiowego. Posiadany roztwór jodyny rozcieńczamy etanolem (np. odbarwionym denaturatem) w stosunku 1:1. Napełniamy nim biuretę lub pipetę i powoli wkraplamy roztwór jodu do kolby (cały czas mieszając jej zawartość). Trwałe niebieskie zabarwienie oznacza całkowite zmiareczkowanie witaminy C. Odczytujemy objętość zużytego roztworu jodu i obliczamy, ilu cm3 odpowiada zawartość 1 mg kwasu askorbinowego w roztworze. W przypadku posługiwania się tylko zakraplaczem, wiemy, ile kropli jest ekwiwalentem 1 mg witaminy C. Dla zwiększenia dokładności powtarzamy miareczkowanie i jako wynik przyjmujemy średnią objętość zużytego roztworu. Teraz można wykryć obecność witaminy C w sokach owocowych, a przy okazji sprawdzić jej zawartość podaną przez producenta.
Co niszczy witaminę C?
Już w ubiegłym miesiącu przekonaliśmy się, że kwas askorbinowy jest związkiem łatwo reagującym z utleniaczami. Istnieje wiele czynników, które przyspieszają degradację witaminy C, czego konsekwencją staje się spadek jej zawartości w produktach żywnościowych.
Do prób przygotowujemy roztwory kwasu askorbinowego o znanej masie tego związku (jak w przypadku mianowania roztworu jodu). Po zakończeniu eksperymentu miareczkujemy próbki i obliczamy, o ile zmniejszyła się ilość witaminy C.
- Pierwszą próbkę wystawiamy w odkrytym naczyniu na dwanaście godzin na działanie światła słonecznego. Drugą, również w odkrytym naczyniu, przechowujemy w ciemności (nie w lodówce). Następnie wykonujemy miareczkowanie.
- Próbkę gotujemy przez 15-20 minut (można uzupełniać wyparowaną wodę), a po ostygnięciu miareczkujemy.
- Pierwszą próbkę zakwaszamy, dodając łyżeczkę spożywczego octu (10% roztwór kwasu octowego) lub szczyptę kwasu cytrynowego (również dostępnego w sklepach spożywczych). Do drugiej próbki wsypujemy łyżeczkę wodorowęglanu sodu NaHCO3 (dostępnego w sklepach spożywczych jako soda oczyszczona) lub niewielką ilość roztworu NaOH. Pozostawiamy próbki w odkrytych naczyniach w ciemności i miareczkujemy po upływie dwunastu godzin.
- Do pierwszej próbki wkładamy kawałek drutu miedzianego, do drugiej – aluminiowego, a do trzeciej żelazny gwóźdź. Naczynia pozostawiamy otwarte bez dostępu światła, a po dwunastu godzinach miareczkujemy ich zawartości (3).
Otrzymane wyniki mogą się znacznie różnić, w zależności od posiadanego roztworu jodu, wielkości użytej próbki i warunków eksperymentu. Jednak w każdym przypadku stwierdzimy niszczące działanie badanych czynników (światła, dostępu tlenu, podwyższonej temperatury, zasadowego odczynu roztworu, kontaktu z metalami) na zawartość witaminy C.
Jak zminimalizować straty?
Strat witaminy C nie da się uniknąć podczas przygotowywania i przechowywania potraw. Można jednak wykorzystać wnioski z wykonanych doświadczeń do zmniejszenia jej ubytków.
- Kwas askorbinowy bardzo dobrze rozpuszcza się w wodzie. Unikajmy więc długotrwałego przechowywania warzyw w wodzie (np. ziemniaków czy kalafiora).
- Witamina C jest wrażliwa na działanie światła i tlenu zawartego w powietrzu (zwłaszcza oba te czynniki razem mają niezwykle destrukcyjne działanie). Wniosek? Gotowe potrawy przechowujemy w zamkniętym naczyniu i nie wystawiamy na działanie światła (najlepiej w lodówce).
- Również gotowanie w znacznym stopniu niszczy kwas askorbinowy. Należy zatem jak najwięcej warzyw i owoców spożywać na surowo, a gdy trzeba poddać je obróbce cieplnej – gotować szybko w niewielkiej ilości wody (jeszcze lepiej na parze).
- Witamina C znacznie szybciej ulega niszczeniu w roztworze o odczynie zasadowym (i obojętnym). Należy zakwaszać zawierające ją potrawy, np. sokiem z cytryny, octem lub kwasem cytrynowym.
- Kontakt z metalami działa niszcząco na witaminę C. Unikajmy więc przechowywania potraw o dużej zawartości kwasu askorbinowego w metalowych naczyniach. Do ucierania warzyw i owoców używajmy tarek z tworzyw sztucznych zamiast metalowych.
Podane rady nie wymagają rewolucyjnych zmian w kuchennej technologii, a mogą przyczynić się do zwiększenia wartości odżywczych sporządzanych potraw. Dla zdrowia własnego i domowników warto wprowadzić je w życie.
„Apteczna reakcja zegarowa”
Na zakończenie (dla wytrwałych czytelników, którzy dobrnęli do tego miejsca w artykule), jeszcze jeden eksperyment z udziałem witaminy C.
Do już posiadanych odczynników wystarczy dodać wodę utlenioną (3% roztwór H2O2, preparat dostępny w aptekach i drogeriach jako środek dezynfekcyjny) (4) Wielu czytelników może już znać „apteczną reakcję zegarową” (była prezentowana m.in. w dziale chemicznym „Młodego Technika” w numerze 2/2014), ale jej niecodzienny przebieg sprawia, że doświadczenie zawsze warte jest wykonania.
Do zlewki lub kolby wlewamy ok. 50 cm3 roztworu witaminy C (zawierającego ok. 50 mg kwasu askorbinowego) i dodajemy 1-2 cm3 jodyny. Następnie wlewamy pół łyżeczki wskaźnika skrobiowego i 10-15 cm3 wody utlenionej. Po kilkunastu sekundach zawartość naczynia raptownie barwi się na ciemny kolor (5).
„Apteczna reakcja zegarowa” jest odmianą zegarowej reakcji Harcourta. Po dodaniu jodu do roztworu następuje jego reakcja z kwasem askorbinowym:
Wydzielony jod ponownie ulega redukcji przy pomocy witaminy C. Dopiero, gdy wyczerpie się cała ilość kwasu askorbinowego, wolny jod reaguje ze skrobią, barwiąc zawartość zlewki. Poprzez zmiany ilości reagentów możemy regulować czas pojawienia się końcowego efektu (np. zwiększenie ilości witaminy C przedłuży czas oczekiwania).
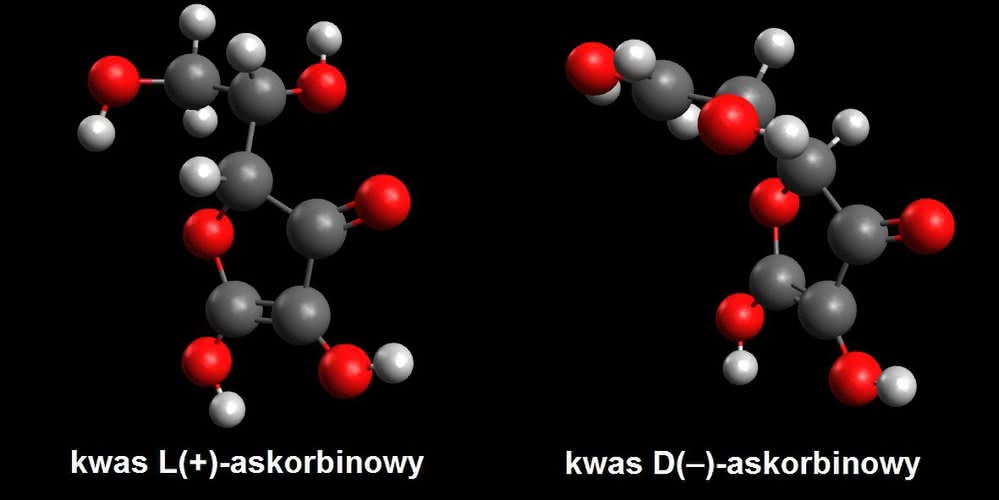
To jeden z nowych medycznych mitów. Oskarża się w nim przemysł farmaceutyczny o to, że w aptekach sprzedawane są nic niewarte preparaty witaminy C. Jedynie skuteczne mają być te dostępne w internetowych sklepach (oczywiście za odpowiednio wysoką cenę). Rzekomym powodem jest to, że przemysłowe produkty mają zawierać witaminę C prawoskrętną lub mieszaninę odmian. O co chodzi w tym zamieszaniu?
Istnieją związki chemiczne o tym samym składzie i jednakowych wzorach strukturalnych, lecz nadal różniące się od siebie. Różnice ujawniają się w subtelnej postaci – izomery skręcają płaszczyznę światła spolaryzowanego w odwrotne strony (izomeria optyczna). Wiele biocząsteczek wykazuje ten rodzaj izomerii, a organizmy żywe zazwyczaj wytwarzają tylko jedną odmianę związku (druga jest nieczynna biologicznie lub nawet toksyczna). Nie inaczej jest z witaminą C. Pełna jej nazwa to kwas L-(+)-askorbinowy. Znak plusa informuje o kierunku skręcalności – w prawo (znak minus ma związek skręcający w lewo). Natomiast litera L oznacza tylko konfigurację ustaloną względem pewnego wzorcowego związku (wybrana grupa w cząsteczce jest skierowana w zapisanym wzorze w lewą stronę – litera D oznaczałaby grupę skierowaną w prawo). Oznaczenie literowe nie ma natomiast nic wspólnego z faktycznym kierunkiem skręcalności (prawoskrętne mogą być zarówno związki o konfiguracji L, jak i D) (6).
Pełen wzór witaminy C pozwala stwierdzić, że jest ona związkiem prawoskrętnym. Oczywiście istnieje lewoskrętny izomer witaminy, ale nie ma on jej właściwości fizjologicznych. Lewoskrętna witamina C to, niestety, kolejny przykład wykorzystania ludzkiej niewiedzy.