Chemiczny gabinet osobliwości - część 2
Chemiczne drzewa
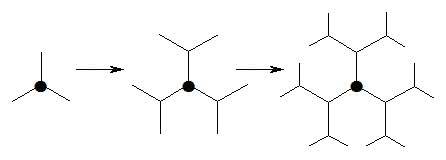
Podandy, związki, w których do centralnej części cząsteczki przyłączone są długie łańcuchy, dały początek nowej klasie substancji (o „chemicznych ośmiornicach” więcej w artykule z ubiegłego miesiąca). Chemicy postanowili zwiększyć liczbę „macek”. W tym celu do każdego z ramion, zaopatrzonego na końcu w zdolne do reakcji ugrupowanie atomów, przyłączano kolejną cząsteczkę, zakończoną odpowiednimi grupami (dwiema lub więcej; chodzi o zwiększanie liczby miejsc mogących łączyć się z innymi drobinami). Z nią reagowały kolejne molekuły, potem następne i tak dalej. Wzrost rozmiarów całego układu obrazuje szkic:
Chemikom nowe związki skojarzyły się z rosnącymi gałęziami drzewa, stąd nazwa dendrymery (gr. dendron = drzewo, meros = część). Początkowo konkurowało z nią określenie „arborole” (to z łaciny, gdzie arbor również znaczy drzewo) lub „cząsteczki kaskadowe”. Autorowi co prawda bardziej przypominają splątane macki meduzy lub osiadłych ukwiałów, ale to odkrywcy mają oczywiście prawo nadania nazwy. Trafnym spostrzeżeniem jest także skojarzenie dendrymerów ze strukturami fraktalnymi.
Dendrymery nie mogą rozrastać się w nieskończoność (1). Liczba rozgałęzień rośnie w postępie geometrycznym i po kilku-kilkunastu etapach przyłączania nowych cząsteczek na powierzchni kulistegotworu kończy się wolna przestrzeń (całość osiąga nanometrowe rozmiary; nanometr to miliardowa część metra). Za to możliwości manipulacji własnościami dendrymeru są praktycznie nieograniczone. Ugrupowania obecne na powierzchni mogą być hydrofilowe („lubiące wodę”, czyli wykazujące powinowactwo z nią i rozpuszczalnikami polarnymi) albo hydrofobowe („unikające wody”, za to dążące do kontaktu z cieczami niepolarnymi, np. większością rozpuszczalników organicznych). Podobnie wnętrze cząsteczki może mieć charakter polarny lub też niepolarny. Pod powierzchnią dendrymeru, pomiędzy poszczególnymi gałęziami, znajdują się wolne przestrzenie, do których można wprowadzić wybrane substancje (na etapie syntezy lub później; można je również przyłączyć do grup powierzchniowych). Zatem wśród chemicznych drzewek każdy znajdzie coś odpowiedniego dla swoich potrzeb. Ty zaś, Czytelniku, zanim zapoznasz się z dalszą częścią artykułu, zastanów się, do czego można wykorzystać molekuły, które – stosownie do budowy – będą dobrze się „czuły” w każdym środowisku, a w ich wnętrzu da się umieścić inne substancje?
Oczywiście jako kontenery transportujące wybrane związki i chroniące ich zawartość (2). To właśnie główne zastosowania dendrymerów. Co prawda nadal w większości w fazie badań, ale niektóre wprowadzono już do praktyki. Dendrymery świetnie nadają się do przenoszenia leków w wodnym środowisku naszego ciała. Niektóre medykamenty trzeba specjalnie modyfikować, aby rozpuszczały się w płynach ustrojowych – użycie przenośników pozwoli uniknąć tych przekształceń (mogą one negatywnie wpływać na działanie leku). Dodatkowo substancja czynna uwalnia się powoli z wnętrza kapsuły, co sprawia, że dawki mogą być mniejsze i rzadziej przyjmowane. Przyłączenie różnych cząsteczek do powierzchni dendrymeru powoduje, że są one rozpoznawane tylko przez komórki poszczególnych narządów. To zaś umożliwia transport leku wprost do celu, bez niepotrzebnego narażania całego organizmu na działania uboczne, np. w terapii antynowotworowej.
Kosmetyki tworzone są zarówno na bazie wody, jak i tłuszczów. Często jednak substancja czynna jest rozpuszczalna w tłuszczach, a kosmetyk ma postać roztworu wodnego (i odwrotnie: substancja rozpuszczalna w wodzie musi być zmieszana z bazą tłuszczową). Dodatek emulgatorów (umożliwiają powstanie trwałego roztworu wodno-tłuszczowego) nie zawsze działa korzystnie. Laboratoria firm kosmetycznych starają się więc wykorzystać potencjał tkwiący w dendrymerach jako przenośnikach, które łatwo można dostosować do potrzeb. Z analogicznymi problemami boryka się przemysł środków ochrony roślin. Tu również często zachodzi potrzeba zmieszania niepolarnego pestycydu z wodą. Dendrymery ułatwiają połączenie, a ponadto – stopniowo uwalniając środek ze swego wnętrza - powodują ograniczenie ilości substancji toksycznych. Inne zastosowanie to przenoszenie nanocząstek metalicznego srebra, o znanym działaniu niszczącym drobnoustroje. Prowadzi się również badania nad zastosowaniem dendrymerów do transportu antygenów w szczepionkach oraz fragmentów DNA w badaniach genetycznych. Możliwości jest zresztą więcej, wystarczy uruchomić wyobraźnię.
Kubełki
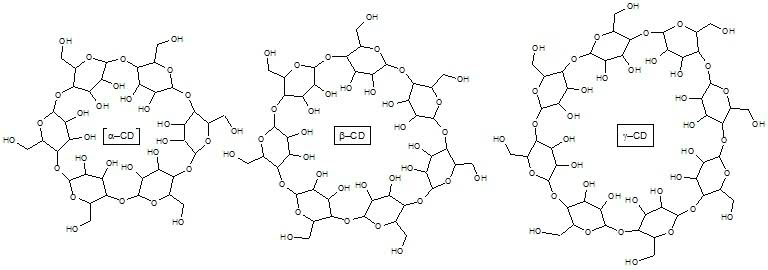
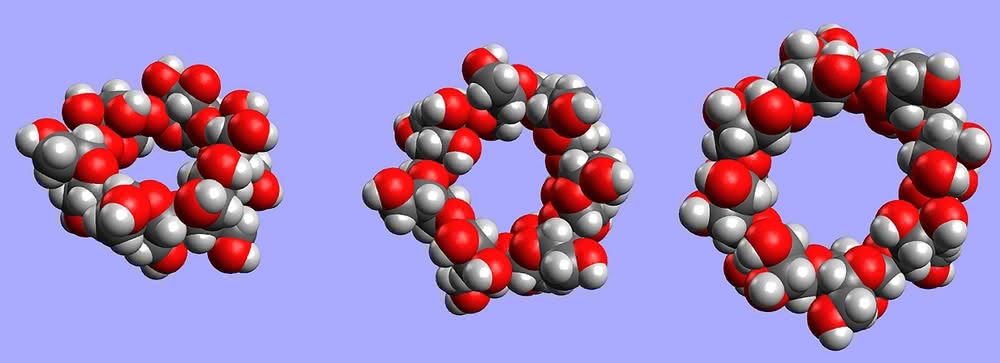
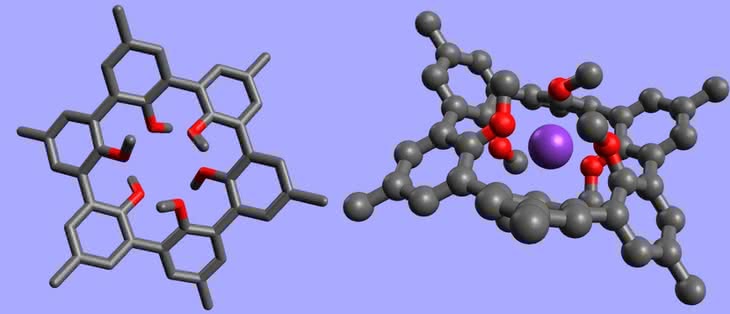
Glukoza to najbardziej rozpowszechniony związek organiczny w świecie ożywionym. Szacuje się, że rocznie powstaje w ilości rzędu 100 mld ton! Podstawowy produkt fotosyntezy organizmy wykorzystują na różne sposoby. Glukoza jest źródłem energii w komórkach, służy jako materiał zapasowy (roślinna skrobia oraz zwierzęcy glikogen) i budulec (celuloza). Na przełomie XIX i XX wieku zidentyfikowano cyklodekstryny (w skrócie CD) jako produkty częściowego rozpadu skrobi pod wpływem enzymów bakteryjnych. Jak wskazuje nazwa, są to związki cykliczne, czyli pierścieniowe:
Składają się one z sześciu (odmiana a–CD), siedmiu (b–CD) lub ośmiu (g–CD) cząsteczek glukozy, choć znane są i większe pierścienie (3). Dlaczego jednak produkty metabolizmu jakichś tam bakterii są na tyle interesujące, że poświęca się im miejsce w „Młodym Techniku”?
Po pierwsze, cyklodekstryny to związki dobrze rozpuszczalne w wodzie, co wszakże nie powinno dziwić – mają stosunkowo niewielkie rozmiary i składają się z dobrze rozpuszczalnej glukozy (skrobia tworzy zbyt wielkie cząsteczki, aby mógł powstać roztwór, ale da się otrzymać jej zawiesinę). Po drugie, liczne grupy OH oraz atomy tlenu glukozy są zdolne do wiązania innych cząsteczek. Po trzecie, cyklodekstryny otrzymywane są w prostym procesie biotechnologicznym z taniej i dostępnej skrobi (obecnie w ilości tysięcy ton rocznie). Po czwarte, pozostają substancjami całkowicie nietoksycznymi. I na koniec, najbardziej oryginalny jest ich kształt (który Ci, Czytelniku, powinien podpowiedzieć zastosowanie tych związków): Kubełek bez dna, czyli cyklodekstryny nadają się do przenoszenia innych substancji (cząsteczka, która przejdzie przez większy otwór, nie wypadnie z pojemnika dołem, a ponadto jest wiązana siłami międzyatomowymi). Nieszkodliwość dla zdrowia powoduje, że można ich używać jako składnik medykamentów i żywności.
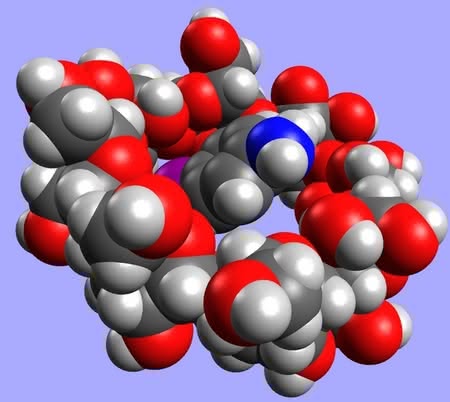
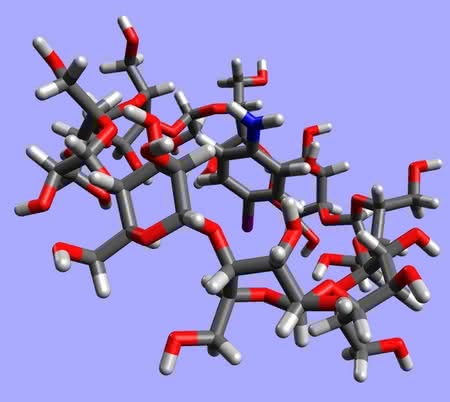
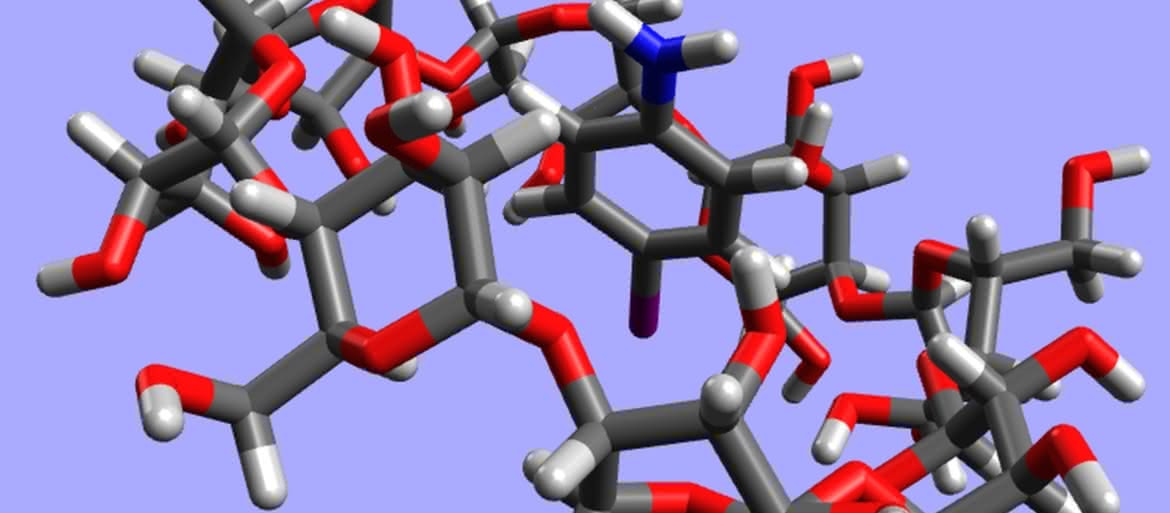
Jednak pierwszym zastosowaniem cyklodekstryn, odkrytym wkrótce po opisaniu, była aktywność katalityczna. Przypadkowo okazało się, że pewne reakcje z ich udziałem zachodzą w całkiem inny sposób, niż gdy w środowisku nie ma tych związków. Powodem jest wchodzenie cząsteczki substratu („gościa”) do środka kubełka („gospodarza”) (4, 5). Część molekuły jest więc niedostępna dla reagentów i przemiana może zachodzić tylko w tych miejscach, które wystają na zewnątrz. Mechanizm działania jest analogiczny, jak w przypadku wielu enzymów, również „maskujących” fragmenty cząsteczek.
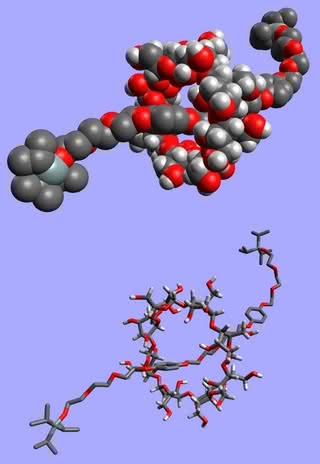
Jakie molekuły mogą być przechowywane wewnątrz cyklodekstryn? Właściwie każde, które się zmieszczą w środku – decydujące jest wzajemne dopasowanie rozmiarów gościa i gospodarza (jak w przypadku eterów koronowych i ich pochodnych; patrz – artykuł z ubiegłego miesiąca) (6). Ta własność cyklodekstryn
cząsteczki, czyli rotaksan (więcej: w numerze
styczniowym)
powoduje, że używane są do wybiórczego wychwytywania związków ze środowiska. W ten sposób oczyszcza się substancje oraz wyodrębnia je z mieszaniny po reakcji (np. przy produkcji leków).
Inne zastosowania? Można by przytoczyć fragmenty poprzedniego artykułu cyklu (modele enzymów i przenośników; nie tylko jonowych – cyklodekstryny transportują różne substancje) oraz urywek opisujący dendrymery (przenoszenie substancji czynnych w medykamentach, kosmetykach i środkach ochrony roślin). Zalety opakowania z cyklodekstryn są również podobne – całość rozpuszcza się w wodzie (w przeciwieństwie do większości leków, środków pielęgnujących urodę i pestycydów), substancja czynna jest uwalniana stopniowo i działa dłużej (co pozwala zmniejszyć dawki), a zużyte pojemniki ulegają biodegradacji (drobnoustroje szybko rozłożą produkt naturalny, jest on również metabolizowany w organizmie człowieka). Zawartość opakowania jest także chroniona przed wpływami środowiska (zmniejszony dostęp do przechowywanej cząsteczki). Środki ochrony roślin umieszczone w cyklodekstrynach mają wygodną do stosowania postać. Jest to biały proszek, podobny do mąki ziemniaczanej, który przed użyciem rozpuszcza się w wodzie. Odpada więc używanie niebezpiecznych i palnych rozpuszczalników organicznych.
Przeglądając listę zastosowań cyklodekstryn, znajdziemy na niej kilka innych „smaczków”, a także „zapaszków”. O ile pierwsze sformułowanie jest często używaną przenośnią, o tyle drugie może zaskoczyć. Chemiczne kubełki służą jednak do usuwania nieprzyjemnych woni, a także przechowywania i uwalniania pożądanych aromatów. Odświeżacze powietrza, pochłaniacze zapachów, perfumy i zapachowe papiery to tylko kilka przykładów użycia kompleksów cyklodekstryn. Ciekawostką jest fakt dodawania związków zapachowych opakowanych w cyklodekstryny do proszków do prania. Podczas prasowania i noszenia następuje stopniowy rozkład i uwalnianie aromatu.
Pora na smak. „Gorzki lek najlepiej leczy”, ale smakuje fatalnie. Jeśli jednak zostanie podany w postaci kompleksu z cyklodekstryną, nie będzie nieprzyjemnych wrażeń (substancja jest odizolowana od kubków smakowych). Z pomocą cyklodekstryn usuwa się również goryczkę z soku grapefruitowego. Wyciągi z czosnku oraz innych przypraw są znacznie trwalsze w postaci kompleksów niż w stanie wolnym. Podobnie opakowane aromaty poprawiają smak kaw i herbat. Dodatkowo na korzyść cyklodekstryn przemawia obserwacja ich działania antycholesterolowego. Cząsteczki „złego” cholesterolu są wiązane wewnątrz chemicznego kubełka i w tej postaci eliminowane z organizmu. Zatem cyklodekstryny, produkty pochodzenia naturalnego, to również samo zdrowie.