Chemiczny gabinet osobliwości - część 1
Jeśli istnieje królestwo, musi być w nim i korona. Jest, a nawet cała rodzina, zwana eterami koronowymi.
Korony
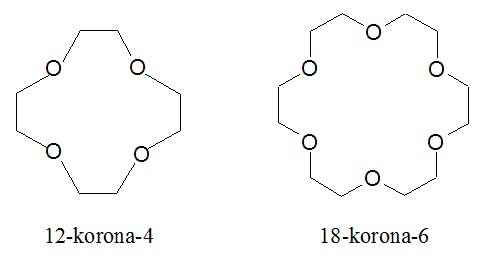
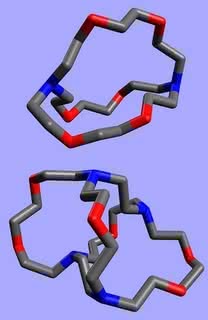
Etery to związki, w których atom tlenu znajduje się pomiędzy dwoma ugrupowaniami węglowodorowymi. W eterach koronowych atomy łączą się ze sobą w pierścień, a całość bardziej przypomina wieniec z liści laurowych (od którego zresztą korona się wywodzi) niż atrybut władzy królewskiej. Nazwy eterów koronowych są skomplikowane, dlatego powszechnie używa się zapisów umownych, np. 18-korona-6 to związek, którego pierścień utworzony jest z 18 atomów, z czego 6 to tlen (w pokrewnych związkach zamiast tlenu znajduje się również siarka lub azot). Wzory eterów koronowych - zwanych też koronandami - są nadzwyczaj symetryczne (1):
W miejscach łączenia wiązań znajdują się atomy węgla z odpowiednią liczbą atomów wodoru. To zwykle stosowany sposób zapisu cząsteczek związków organicznych, który ma na celu bardziej czytelne pokazanie struktury molekuły.
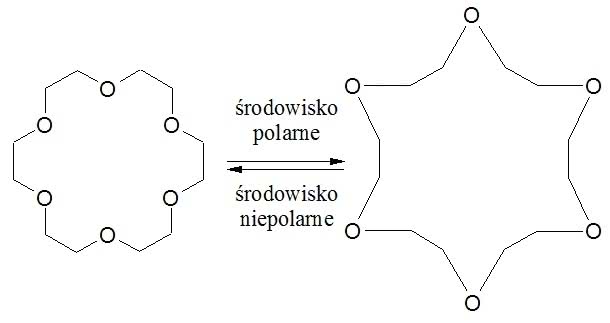
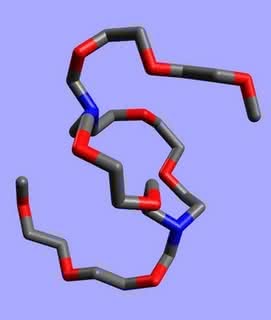
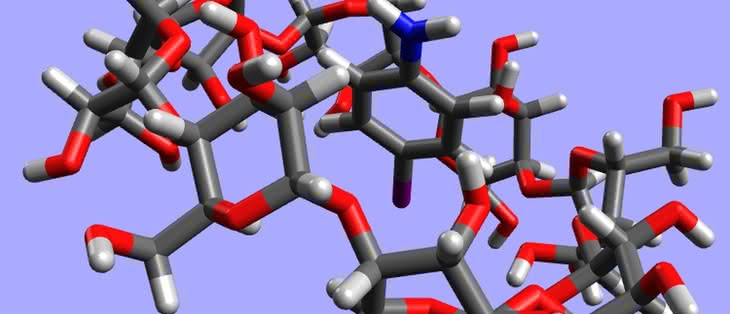
Etery koronowe ciekawie zachowują się w różnych rozpuszczalnikach. I tak, w niepolarnej cieczy organicznej polarne i hydrofilowe („lubiące wodę”) atomy tlenu chowają się do środka, a na zewnątrz wystają niepolarne fragmenty węglowodorowe. W polarnej wodzie jest odwrotnie: teraz atomy tlenu znajdują się na zewnątrz, a części hydrofobowe („nielubiące wody”) ulegają przemieszczeniu do środka:
Dzięki takim „umiejętnościom” etery koronowe rozpuszczają się praktycznie w każdej cieczy.
- To ciekawe - ziewnie, być może nieco już znudzony, Czytelnik. - Ale czy te związki do czegoś się przydają? Czy też ich badania to zwyczajna „sztuka dla sztuki”?
Uspokajam Cię, Czytelniku. Etery koronowe jak najbardziej mają zastosowania praktyczne. Przecież w roku 1987 Nagroda Nobla z chemii trafiła do badających je uczonych (Donald J. Cram, Jean-Marie Lehn, Charles J. Pedersen) nie za ładny wygląd otrzymanych cząsteczek. Najciekawsze dopiero nastąpi.
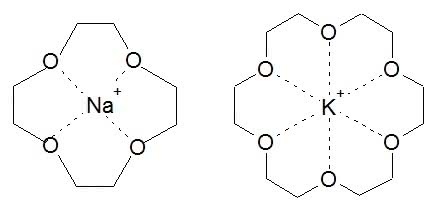
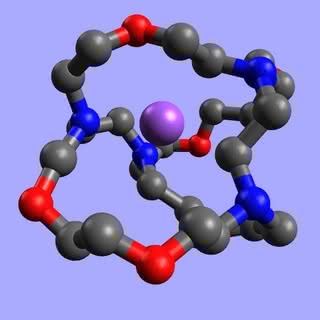
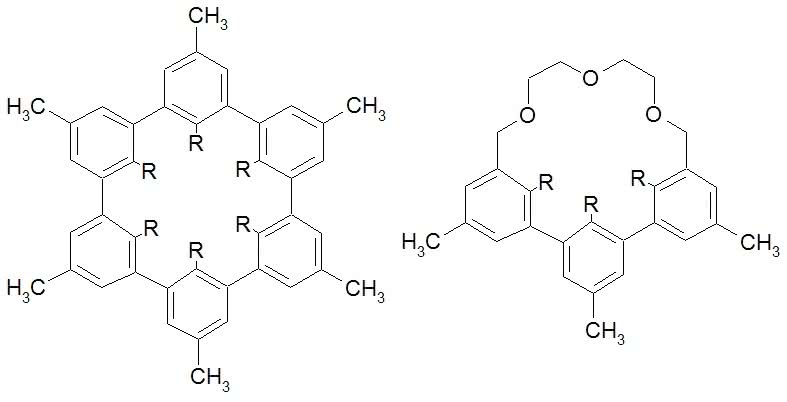
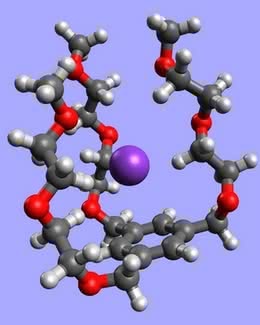
Koronandy wiążą się w kompleksy z kationami metali grup I i II, a trzeba Ci, Czytelniku, wiedzieć, że tylko nieliczne związki to potrafią (litowce i berylowce są bardzo „niechętne” do takich połączeń). Ponadto wykazują zdumiewającą selektywność - poszczególne korony tworzą kompleksy przeważnie tylko z jednym rodzajem jonu (z innymi o wiele trudniej). Co o tym decyduje? Reguła jest najprostsza, jaką można sobie wyobrazić - wzajemne dopasowanie wnęki i jonu. Kompleks tworzy się tym łatwiej i wiązanie w nim jest mocniejsze, im rozmiar wchodzącej do środka drobiny bardziej pasuje do wolnego miejsca wewnątrz pierścienia. Zbyt duży jon wystaje ponad koronę i wiązania nie są położone w płaszczyźnie symetrii układu (2). W przypadku jonu o zbyt małej średnicy tworzone wiązania są za długie lub też korona musi się zgiąć w celu dopasowania. We wszystkich przypadkach dochodzi do osłabienia wiązań. A tak np. wygląda jon Na+ kompleksowany przez 12-koronę-4 oraz jon K+ (o większej średnicy) wewnątrz 18-korony-6:
„Zwinięcie się” związku (atomy tlenu znajdują się w środku, na zewnątrz wystają fragmenty węglowodorowe) ułatwia przechodzenie kompleksu do rozpuszczalnika niepolarnego. Ponieważ musi być zachowany warunek elektroobojętności układu, za kompleksami wędrują również aniony wchodzące w skład soli (np. Cl-, gdy w roztworze wodnym znajdował się chlorek sodu). Anion, pozbawiony otoczki polarnych cząsteczek wody, staje się bardzo reaktywny, co umożliwia dokonanie przemian, które w zwykłych warunkach wymagają wysokiej temperatury (a związki organiczne bardzo tego „nie lubią”), albo nawet wcale nie zachodzą.
Łączenie się tylko z określonymi jonami umożliwia działanie eterów koronowych jako selektywnych katalizatorów niektórych reakcji, w sposób zbliżony do enzymów. Moc wiązania jonów nie jest zbyt wielka, ale to wcale nie wada. Stosunkowo łatwe uwalnianie kationów powoduje, że koronandy służą jako model przenośników transportujących jony poprzez błonę komórkową (patrz: artykuł z ubiegłego miesiąca). Selektywność wobec drobin o odpowiednich rozmiarach wykorzystywana jest również do usuwania niepożądanych metali ze środowiska, np. oczyszczania wody (pod warunkiem dobrania właściwej średnicy korony). Z wykorzystaniem eterów koronowych zbudowano także detektory umożliwiające wykrycie i ilościowe oznaczenia określonych jonów metali. Znalazło to zastosowanie np. w analityce medycznej do oznaczania stężenia potasu. Pomiar przy użyciu odpowiedniego czujnika jest szybki (co ma znaczenie przy badaniach wykonywanych na cito) i dokładny (nie przeszkadza nawet kilkaset razy większe stężenie sodu, chemicznie bardzo podobnego do potasu).
Schowki
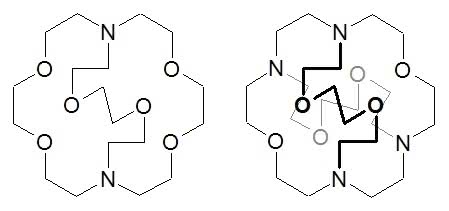
Gdyby etery koronowe były organizmami żywymi, to - patrząc na rozwój chemii ich pochodnych - można by mówić o ewolucji i powstawaniu nowych gatunków. Korzystne „mutacje” w tym przypadku polegały na dobudowywaniu fragmentów z następnymi miejscami wiążącymi jony metali, czyli atomami tlenu lub azotu. W ten sposób w chemicznym świecie pojawiły się swoiste schowki na jony, czyli kryptandy. Na przykład potomek 18-korony-6 z dołączoną jeszcze jedną oraz dwoma połówkami pierścienia (3):
Budowa tych związków powoduje, że jon wchodzący do środka (zwany „gościem”) jest jeszcze silniej wiązany przez kryptand (czyli „gospodarza”) niż w przypadku eterów koronowych. Dodatkowo drobina znajdująca się wewnątrz krypty jest również lepiej osłonięta od wpływu rozpuszczalnika. Właściwości kryptandów umożliwiają otrzymanie tak egzotycznych tworów, jak aniony litowców, np. Na- (towarzyszący mu kation Na+ znajduje się wewnątrz krypty, oczywiście całość wymaga środowiska bezwodnego). Kryptandy są jeszcze bardziej selektywne pod względem rozmiaru goszczonych jonów niż korony - drobina musi się zmieścić w środku (4).
Zastosowania? Jak w przypadku eterów koronowych: katalizatory, modele układów biologicznych (wiele enzymów i przenośników jonowych ma w swej strukturze podobne krypty), usuwanie wybranych jonów ze środowiska, wykrywanie i oznaczanie związków metali.
Ośmiornice
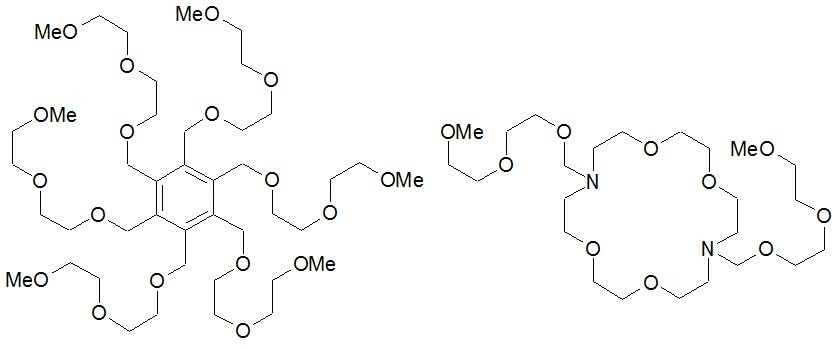
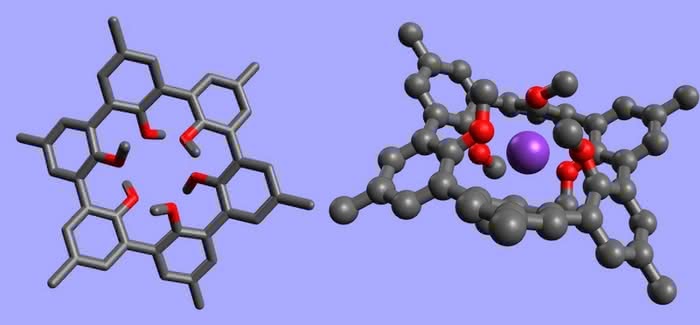
Inna „linia ewolucyjna” postawiła na rozwój ramion, które wyrastają z centralnej części molekuły (zapis -OMe to skrót od -OCH3) (5):
Widoczny z prawej strony, nieco przekształcony eter koronowy (z atomami azotu zastępującymi tlen w niektórych miejscach; chodzi o dodatkową wartościowość, którą wykorzystuje się na dołączenie ramienia) również jest zaliczany do nowej klasy związków (swego rodzaju „hybryda międzygatunkowa”). Nazwano je podandami, choć bardziej przypominają ośmiornice (co prawda ramion jest mniej), a atomy tlenu zdolne do łączenia się z jonami metali to nic innego, jak przyssawki tych morskich głowonogów. Podobieństwo jest jeszcze wyraźniej widoczne, gdy podand utworzy kompleks - całość do złudzenia wygląda jak ośmiornica ramionami wpychająca pokarm do swojego dzioba (6).
Synteza podandów jest prostsza niż poprzednich związków - łatwiej jest tylko dołączyć łańcuch do cząsteczki niż potem zamknąć go w pierścień. Stosunkowo luźna konstrukcja „chemicznych ośmiornic” sprawia, że wiążą one jony metali o różnych rozmiarach, bez szczególnych różnic w trwałości powstających kompleksów. Podandy są więc mniej selektywne niż etery koronowe, a zwłaszcza kryptandy. Moc wiązania jonu jest również mniejsza niż w przypadku związków pierścieniowych (rośnie wraz ze zwiększaniem się liczby ramion). Nie jest to jednak wada w pewnych zastosowaniach - oznacza łatwe uwalnianie pochwyconych drobin, gdy będzie to potrzebne. Z tego względu podandy stosuje się głównie jako przenośniki jonowe.
Sztywne obręcze
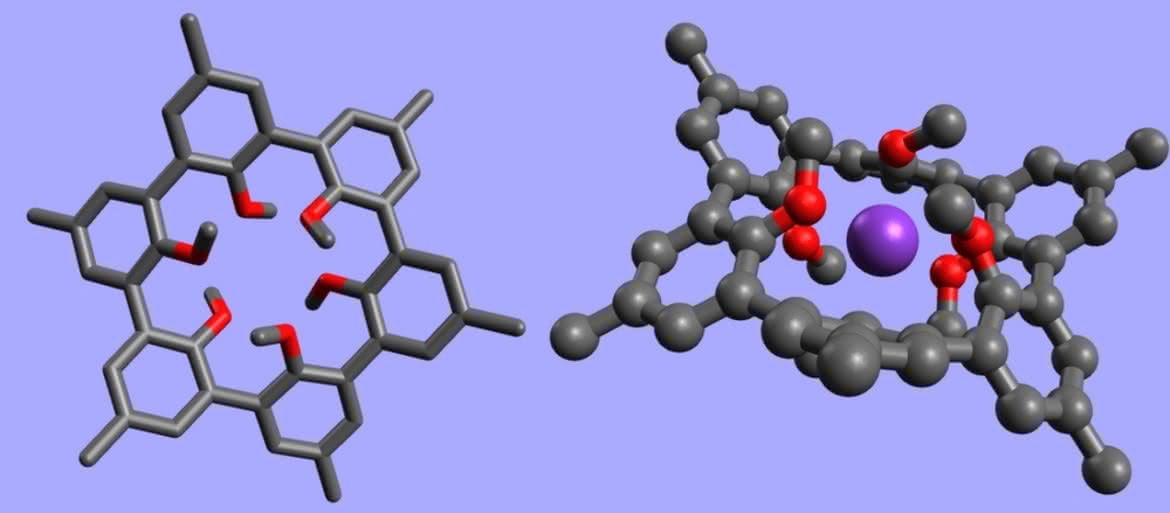
Odmienną „strategię ewolucyjną” niż łatwo dopasowujące się podandy wybrała kolejna grupa z chemicznego gabinetu osobliwości - sferandy. W ich przypadku szkielet związku zawiera fragmenty nieulegające deformacjom, co nadaje cząsteczce sztywność (R oznacza grupę z atomem tlenu wiążącym jon metalu; molekuła z prawej strony to kolejna hybryda eteru koronowego):
Taka budowa powoduje, że sferandy są najbardziej selektywne, jeśli chodzi o wiązanie jonów (7). [sferand] Zwykle do wnętrza cząsteczki pasuje tylko jeden ich rodzaj, a inne po prostu „nie wchodzą” (gdy są za duże) lub w ogóle nie wytwarza się wiązanie (gdy średnica jest za mała). Za to siła wiązania jest największa w porównaniu do pozostałych związków (ogólnie: im mniejsza deformacja molekuły, tym tworzy ona mocniejsze wiązanie z goszczonym jonem). Kompleksy sferandów są tak trwałe, że nie stosuje się ich jako przenośniki i czujniki (szybko uległyby zablokowaniu), a tylko do nieodwracalnego usuwania metali ze środowiska.
Cząsteczki na miarę
Historia badań eterów koronowych i ich pochodnych to modelowy przykład obecnych trendów rozwojowych w chemii i pokaz swoistej „chemicznej ewolucji”. Koronandy, otrzymane jako pierwsze, okazały się wyjątkowymi związkami, zdolnymi do selektywnego łączenia się z jonami metali w sposób podobny do układów biologicznych. Kolejne związki powstały już planowo - w niektórych postawiono na jeszcze większą selektywność i trwałość połączeń, w innych na szybkość wiązania i uwalniania jonów. Wszystko to stosownie do zapotrzebowania zgłaszanego przez laboratoria badawcze i przemysł. Oczywiście, co stało się już rutynowym postępowaniem, cząsteczki nowych związków powstały najpierw jako modele oraz obiekty w pamięci komputera, nie zaś w probówkach i kolbach chemików. Taka procedura zapewnia znaczne przyspieszenie badań i ograniczenie ich kosztów. Obliczenia komputerowe pozwalają stwierdzić, czy molekuły w ogóle mogą istnieć i czy będą miały pożądane właściwości, np. odpowiednie rozmiary wnęki. Dopiero po pozytywnym przejściu wirtualnych testów podejmuje się próby syntezy wybranych cząsteczek. Molekuł na miarę.