Chemiczny Nobel 2018

Nagrodzone prace noblistów to swego rodzaju połączenie chemii z możliwościami świata ożywionego. Nie od dziś zresztą chemicy korzystają z pracy mikroorganizmów, np. na jednym z etapów wytwarzania witaminy C substrat jest przerabiany przez bakterie kwasu octowego. Podobnie postępuje się w przypadku wielu innych środków leczniczych. Tak okazuje się po prostu szybciej i taniej, ponieważ organizmy żywe dysponują wysoce wyspecjalizowanymi i wydajnymi katalizatorami reakcji.
Enzymy…
Mowa oczywiście o enzymach, białkach mających zdolność ułatwiania przebiegu procesów chemicznych niezbędnych do życia komórki. Jak każde białko zbudowane są z aminokwasów. Od kolejności tych cegiełek zależy struktura przestrzenna molekuły. Charakterystyczną cechą enzymów jest obecność wgłębienia utworzonego przez poskręcany łańcuch aminokwasów. W tej pułapce wiązane są cząsteczki substratów, odpowiednio wobec siebie ustawiane, a po reakcji produkt jest uwolniony i cały cykl zaczyna się od nowa. Dzięki temu, że cząsteczki nie muszą się szukać w roztworze, reakcje z udziałem enzymów przebiegają "łatwo, szybko i przyjemnie", czyli z dużą wydajnością, w temperaturze ciała, i do tego zwykle powstaje tylko jeden - żądany - produkt.
W porównaniu z reakcjami enzymatycznymi, procesy stosowane w przemyśle są bardzo toporne. Towarzyszą im wysokie ciśnienie, temperatury rzędu setek stopni Celsjusza, konieczność stosowania stężonych kwasów, zasad oraz innych toksycznych substancji. A katalizatory to z reguły rzadkie i drogie metale. W dodatku z ich wydajnością i selektywnością bywa różnie, co oznacza konieczność wydzielenia potrzebnego produktu spośród wielu zanieczyszczeń, które potem należy zutylizować. Ludzkiej technologii daleko jeszcze do sprawności enzymów, które po wykonaniu swojej pracy zostają rozłożone (przez inne enzymy) na aminokwasy, a z nich organizm buduje nowe białka.
…do poprawy
"Jeśli coś działa, nie ruszaj tego". Tej zasady Frances Arnold widocznie nie uważała za obowiązującą, gdyż w początku lat 90. ubiegłego wieku postanowiła ulepszyć biokatalizatory, które wydawały się i tak już doskonałe. Nie była jednak pierwszą, która podjęła to działanie. Pomijając naturę, od kilku miliardów lat wciąż eksperymentującą ze swoim dziełem, również ludzie przez wieki selekcjonowali szczepy drożdży i bakterii tak, aby w wyniku działania ich enzymów otrzymywać coraz to nowe rodzaje win, serów czy jogurtów. Jednak były to próby wykonywane bez znajomości przebiegających procesów.
W skład enzymów wchodzi około dwudziestu naturalnych aminokwasów, a ponieważ ich cząsteczki zbudowane są nawet z kilkuset cegiełek, daje to praktycznie nieskończoną liczbę możliwych kombinacji. Istotna jest kolejność ułożenia elementów budulcowych, przy czym zmiana nawet jednego aminokwasu może całkowicie zaburzyć pracę enzymu (przykładem są choroby genetyczne). Czasem jednak okazuje się ona nadzwyczaj korzystna, a obdarzony nią organizm ma większe szanse na przeżycie i wydanie potomstwa. Wtedy mutacja rozprzestrzenia się w populacji, prowadząc do rozwoju, a nawet powstania nowego gatunku.
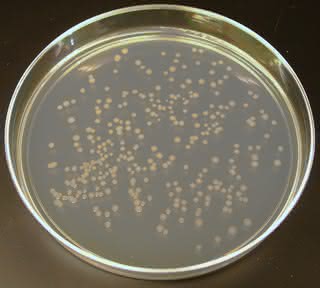
Pani Arnold rozpoczęła eksperymenty z subtilizyną, bakteryjnym enzymem rozkładającym białka. Nie zmieniała jednak każdego z prawie trzystu aminokwasów wchodzących w jego skład. Byłoby to zbyt pracochłonne i niecelowe – o kształcie enzymu decydują tyko aminokwasy znajdujące się w określonych pozycjach łańcucha. Laureatka nie syntezowała jednak białka od podstaw, ale użyła genu, który go koduje. Dzięki opracowanej w latach 80. metodzie możliwe jest składanie genu z fragmentów, jak z klocków. Uczona spowodowała więc losowe zmiany w kluczowych elementach genu, a następnie wprowadzała go do komórki bakteryjnej. Kolonie bakterii rosnące na pożywce powodują widoczne gołym okiem zmiany, np. kółka wokół nich, powstałe z przerobionego podłoża. W ten sposób pani Arnold mogła ocenić pracę zmienionego enzymu. Biokatalizatory szybciej rozkładające pożywkę były ponownie modyfikowane, a te działające gorzej – wędrowały do kosza. Po trzech takich cyklach udało się otrzymać enzym, który działał ponad 250 razy szybciej niż oryginalny. W laboratorium zaszła ewolucja enzymu, a kolejne cykle mutowania, eliminacji mało wydajnych cząsteczek i "rozmnażania" tych skutecznych noszą w naturze nazwę "doboru naturalnego".
Prace laureatki znalazły zastosowanie praktyczne. Już dzisiaj wiele enzymów jest modyfikowanych jej metodą, a nawet powstają odmiany nieistniejące w naturze. Dzięki temu w wydajny sposób wytwarzane są niektóre leki, a producenci środków czystości modyfikują lipazy (enzymy rozkładające tłuszcze) dodawane do detergentów. Trwają także badania nad przemysłowym wykorzystaniem enzymów do produkcji tworzyw sztucznych oraz biopaliw.
Wirusowy pokaz mody
W latach 80. ubiegłego wieku George Smith opracował metodę klonowania pewnych białek. Jako maszyny kopiującej użył bakterii E.coli, mikroorganizmu bytującego w jelitach zwierząt (jest to "królik doświadczalny" mikrobiologów). Gen kodujący białko wprowadził do materiału genetycznego bakteriofaga, czyli wirusa atakującego bakterie. Budowa owego pasożyta jest uproszczona do granic możliwości: składa się on tylko z informacji genetycznej oraz białkowej otoczki. Podczas infekcji otoczka jest odrzucana, a do wnętrza komórki wnika tylko materiał genetyczny, który przyłącza się do DNA gospodarza. Następuje powielanie wirusa, komórka obumiera, a napastnicy atakują kolejne ofiary. Smith poczekał na namnożenie się wirusów w zaatakowanych komórkach, po czym zniszczył ich strukturę tak, aby do roztworu przeszła cała cytoplazma. Jak jednak z powstałej "zupy" wydobyć potrzebne białka?
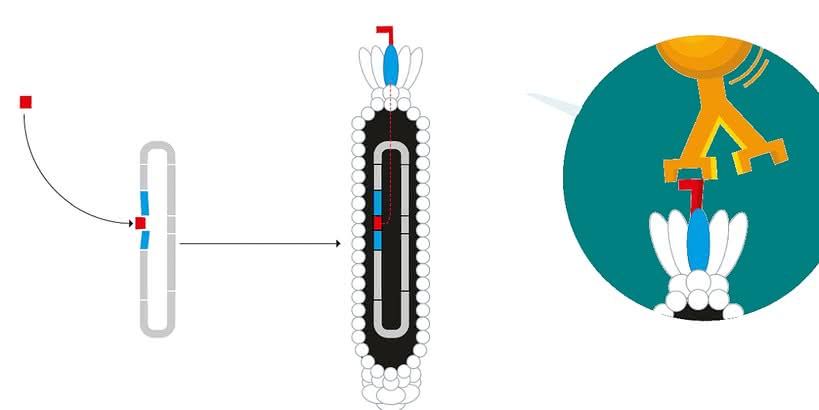
Z pomocą przyszły przeciwciała, czyli białka potrafiące rozpoznawać i łączyć się z innymi białkami. W organizmach pełnią one rolę obrońców przed atakiem szkodliwych drobnoustrojów. Przeciwciała mają budowę przypominającą literę Y. Ramiona przyłączają się do białka znajdującego się np. na powierzchni bakterii, a powstały kompleks może być wyeliminowany przez białe krwinki. Do wydobycia sklonowanych cząsteczek spośród mieszaniny innych związków laureat użył odpowiednich dla danego białka przeciwciał umocowanych na podłożu. Metodę nazwano prezentacją fagową (phage display), ponieważ wirusy prezentowały na swej powierzchni białka utworzone przez bakterię, zupełnie jak modelki dzieła kreatorów mody.
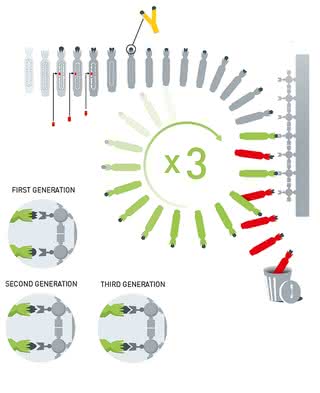
Ewolucja przeciwciał: do DNA wirusa wprowadzany jest gen kodujący przeciwciało (losowo zmutowany), namnożone wirusy z przeciwciałem na powierzchni otoczki są wychwytywane przez białko umieszczone na podłożu, a geny kodujące przeciwciała najlepiej dopasowane do białka są ponownie mutowane (©Johan Jarnestad/The Royal Swedish Academy of Sciences).
Metoda Smitha jest szeroko stosowana w celu kopiowania białek, ale kolejny z laureatów postanowił ją odwrócić. Gregory Winter wprowadził do genomu fragment kodujący przeciwciała, natomiast do wychwycenia wirusa z utworzonym przeciwciałem (obecnym na powierzchni białkowej otoczki) użył białek, z którymi te przeciwciała mogły się wiązać. Nie poprzestał jednak na wychwyceniu wirusów z roztworu, ale poddawał geny kodujące przeciwciała kolejnym mutacjom tak, aby jak najbardziej pasowały do białek, z którymi się łączyły. W ten sposób udało mu się wytworzyć przeciwciała skuteczniejsze niż naturalne w walce z czynnikami chorobowymi. I w tym przypadku nastąpiła ewolucja przeciwciał (zupełnie jak enzymów pani Arnold).
(R)ewolucja w chemii?
Tytuł tego rozdziału został "ściągnięty" z oficjalnej publikacji, opisującej za co laureaci dostali nagrody. Trafnie oddaje on stan badań nad enzymami i antyciałami. Mimo osiągnieć w dziedzinie syntezy chemicznej nadal bardzo trudne jest otrzymywanie białek przez łączenie ich składników, czyli aminokwasów. Skonstruowano już "maszyny do produkcji białek" - aparaturę wykonującą wszelkie operacje chemiczne potrzebne do ich syntezy. Jednak wydajność, a przede wszystkim szybkość, pozostawia wiele do życzenia - to, co komórka potrafi wykonać w ciągu sekund, maszynie zajmuje godziny i dni. W miarę zwiększania wielkości cząsteczki narasta również możliwość wystąpienia błędów w jej budowie (mechanizmy komórkowe są znacznie bardziej niezawodne). Stąd zainteresowanie użyciem organizmów żywych do syntez. Czas pokaże, czy przyniesiecie to prawdziwą rewolucję w chemii. Dlatego też na końcu tytułu stoi znak zapytania.
A co u konkurencji?
Zdarzyło Ci się poślinić palec, aby usunąć nim zabrudzenia? Masz rację. W każdym razie tak twierdzą portugalscy konserwatorzy zabytków, laureaci chemicznego IgNobla 2018. Ślina ludzka zawiera nieco enzymów, ma więc zdolność rozpuszczania zanieczyszczeń pochodzenia biologicznego. Metoda była znana już wcześniej, ale chyba konserwatorzy wstydzili się ją upubliczniać. Ty zaś już wiesz, że ślina nadaje się do czyszczenia nie tylko domowych plam.
Przy okazji: ekipa przyznająca humorystyczne nagrody wykazała się nie lada zdolnościami przewidywania, typując laureatów z chemii właśnie za pracę nad enzymami.
Suplementem do artykułu z poprzedniego miesiąca jest nagroda w dziedzinie biologii. Międzynarodowy zespół udowodnił, że degustatorzy win potrafią wyczuć obecność jednej muszki owocowej, która utopiła się w butelce wina. Co więcej, są nawet w stanie rozpoznać płeć owada (samice wydzielają inne feromony niż samce). Ludzki nos to naprawdę czułe urządzenie.
W dziale chemicznym "Młodego Technik" doświadczenia z enzymami były opisywane w numerach 2-5 z roku 2016, natomiast informacje o białkach (wraz z eksperymentami) Czytelnik znajdzie w numerach 2-3 z 2018 r.