Świat baterii - część 2

Choć zbudowanie ogniwa jest czynnością banalną i trudno nawet policzyć, ile istnieje możliwych kombinacji metali i elektrolitów, to praktyczne znaczenie zdobyły tylko nieliczne modele. Co ciekawe, wiele ze współcześnie stosowanych ma grubo ponad sto lat.
Wieniec i stos
Pierwsze baterie o praktycznym znaczeniu, dziś już nieużywane, skonstruowano u progu XIX wieku (1). Włoski fizyk Alessandro Volta (od jego nazwiska pochodzi nazwa jednostki napięcia) zbudował układ podobny do biwakowej baterii z poprzedniego odcinka.
Do szklanych naczyń wlał roztwór kwasu siarkowego(VI) H2SO4, po czym zanurzył w nich połączone blaszki srebrne i cynkowe tak, aby srebro znajdowało się w jednym kubeczku, a cynk w drugim.
Całość baterii zestawiano w okrąg, w konsekwencji czego pojedyncza elektroda srebrowa i cynkowa znajdowały się obok siebie. Wieniec kubeczków (tak nazwano konstrukcję) umożliwił przeprowadzenie wielu pionierskich doświadczeń, ale nie był zbyt wygodny: groziło rozlanie roztworu, a ponadto po wykonaniu pracy należało wyjąć elektrody z naczyń, ponieważ cynk reagował z kwasem.
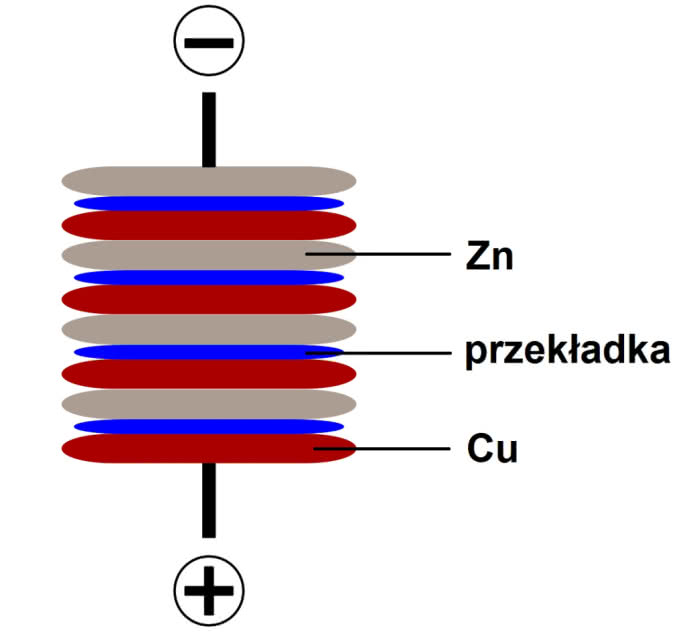
Na modyfikację nie trzeba było długo czekać. Volta ułożył stos z cynkowych blaszek i srebrnych monet, a pary różnych metali przedzielił filcowymi przekładkami nasączonymi wodą morską (oryginalna konstrukcja) lub innym roztworem elektrolitu. Konstruktor podczas prezentacji wynalazku otoczył baterię skórą węgorza elektrycznego.
Raczej nie dysponujesz odpowiednim zapasem srebrnych monet, aby zbudować wierną replikę stosu Volty. Zamiast nich użyj jednak miedzianych oraz cynkowych lub aluminiowych blaszek. Wyczyść powierzchnie metali i ułóż blaszki w sposób widoczny na rysunku (2). Jako przekładek użyj złożonej bibuły lub grubszej tkaniny bawełnianej nasączonej roztworem soli lub sody spożywczej (przekładki nie mogą ociekać roztworem, wystarczy, gdy są tylko wilgotne). Blaszki ustabilizuj tak, aby stos się nie zawalił, i lekko ściśnij (możesz z listewek zbudować ramkę). Zmierz napięcie pomiędzy krańcowymi blaszkami i spróbuj zasilić diodę LED. Stos może być kolejną biwakową baterią.
Konstruowane w początkach XIX wieku stosy dawały napięcie setek woltów i umożliwiły angielskiemu chemikowi Davy’emu otrzymanie kilku nowych pierwiastków (m.in. sodu i potasu). Ogniwo zbudowane przez włoskiego fizyka, a także podobne konstrukcje z tego okresu, miały jednak poważne wady.
Po skończeniu użytkowania układ należało rozmontować, ponieważ płytka cynkowa reagowała z roztworem elektrolitu, co prowadziło do zniszczenia konstrukcji. Drugim mankamentem była polaryzacja elektrody miedzianej. Pod tym pojęciem kryje się wydzielanie pęcherzyków gazu, które przylegają do powierzchni metalu i z biegiem czasy izolują elektrodę od roztworu (co prowadzi do przerwania obwodu).
W służbie telegrafu
Ogniwem, które w swoim czasie zdobyło duże zastosowanie, była konstrukcja autorstwa angielskiego chemika i fizyka Johna Daniella, wykonana w roku 1836. Układ stanowiła blaszka miedziana zanurzona w roztworze siarczanu(VI) miedzi(II) CuSO4 oraz blaszka cynkowa zanurzona w roztworze siarczanu(VI) cynku ZnSO4. Oba roztwory znajdowały się w jednym naczyniu. W naczyniu umieszczona była również porowata przegroda, która zapobiegała mieszaniu obu roztworów, ale umożliwiała kontakt elektryczny pomiędzy nimi (drobne ilości cieczy przenikały w obu kierunkach, zapewniając transport jonów i zamknięcie obwodu). Ponieważ nie stosowano roztworu kwasu, wyeliminowana została wada ogniwa Volty, czyli roztwarzanie cynku w niepracującym układzie. Ponadto na elektrodzie miedzianej nie wydzielał się wodór, co zapobiegało jej polaryzacji.
Wykonaj teraz replikę ogniwa Daniella. W zlewce umieść dopasowany do jej rozmiarów fragment tektury. Uszczelnij połączenie pomiędzy ściankami a przegrodą przy pomocy plasteliny lub silikonu sanitarnego. Do jednej części naczynia wlej roztwór CuSO4, a do drugiej ZnSO4. Poczekaj chwilę, aż ciecze przenikną przez tekturę i zanurz blaszki miedzianą oraz cynkową w roztworach swoich soli. Zmierz napięcie pomiędzy elektrodami - powinno wynosić 0,9-1,1 V.
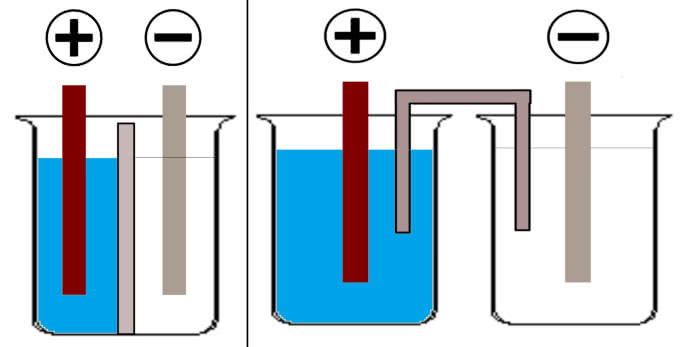
Eksperyment możesz przeprowadzić również w inny sposób. Do jednej zlewki wlej roztwór CuSO4 i zanurz w nim blaszkę miedzianą, a w drugiej umieść roztwór ZnSO4 wraz z blaszką cynkową.
Pomiar napięcia pomiędzy elektrodami wykaże zero - nie zamknąłeś przecież obwodu. Potrzebny ci będzie klucz elektrolityczny, który umożliwi kontakt pomiędzy roztworami, ale zapobiegnie ich mieszaniu. Pod tą nazwą kryje się po prostu pasek kilkakrotnie złożonej bibuły, którego końce zanurzysz w obu zlewkach.
Roztwory przenikają przez bibułę i zapewniają transport jonów w obu kierunkach. Użycie klucza elektrolitycznego (profesjonalne modele są oczywiście bardziej złożone) ma wiele zalet: nie potrzeba przepony, roztwory praktycznie się nie mieszają, a wyjęcie klucza przerywa obwód (3).
Ogniwo Daniella zastosowano do zasilania zbudowanego w tym samym czasie elektrycznego telegrafu. Konstrukcja ogniwa podlegała modyfikacjom. W niektórych modelach ponownie zastosowano roztwór kwasu siarkowego zamiast roztworu ZnSO4, co podniosło sprawność układu (oczywiście należało wyjąć elektrodę cynkową po skończeniu pracy, aby zapobiec jej zniszczeniu).
Telegraf wymusza zmiany
Ogniwo Daniella zasilało telegrafy na całym świecie, ale nadal miało istotną wadę - konieczność posługiwania się roztworami, które zawsze mogły się wylać. Zapotrzebowanie ze strony kompanii telegraficznych spowodowało, że fizycy i chemicy usilnie pracowali nad konstrukcją nowych baterii.
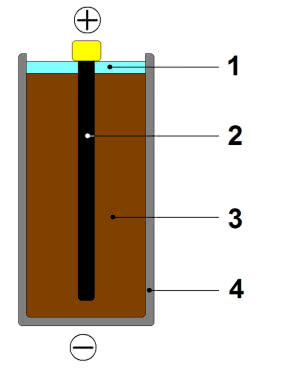
Przełomem okazało się ogniwo, które w roku 1866 zbudował Georges Leclanché. Pierwotna konstrukcja miała główną wadę ogniw Volty i Daniella - nadal używano w niej ciekłego elektrolitu. Ogniwo składało się z naczynia, do którego wstawiano elektrodę cynkową oraz pojemnik z porowatego materiału (np. niepolewanej porcelany). Do pojemnika wsypywano wilgotny proszek dwutlenku manganu MnO2 zmieszany z pyłem grafitowym i umieszczano w nim grafitowy pręt (grafit nadaje się na elektrodę, ponieważ przewodzi prąd). Zewnętrzne naczynie wypełniano stężonym wodnym roztworem chlorku amonu NH4Cl.
Ogniwa Leclanchégo o napięciu pracy ok. 1,5 V zastosowano do zasilania telegrafów, dzwonków elektrycznych, a nawet pierwszych aparatów telefonicznych. Wygodę użytkowania zwiększyło zbudowanie „suchej” wersji ogniwa.
W roku 1887 niemiecki wynalazca Carl Gassner zastąpił ciekły elektrolit mieszaniną chlorku amonu z wilgotnym pyłem gipsowym (obecnie stosuje się do tego celu zwykle kleik skrobiowy lub żel krzemionkowy). Wreszcie przestało grozić rozlanie cieczy. Mimo stosowanej nazwy "suche ogniwo", nie jest ono całkowicie pozbawione wody - gdyby tak było, nie mogłoby funkcjonować. O znakomitym pomyśle francuskiego inżyniera i niemieckiego wynalazcy świadczy fakt, że konstrukcja jest do dziś powszechnie stosowana do zasilania drobnego sprzętu, np. przenośnych radioodbiorników, pilotów telewizyjnych, latarek, aparatów fotograficznych (4).
Sekcja ogniwa
Zużyte ogniwo Leclanchégo to bardzo cenna zdobycz dla twojego domowego laboratorium. Przeprowadzenie jego "sekcji" pozwoli ci uzyskać kilka przydatnych surowców. Najpierw sprawdź, czy rzeczywiście masz do czynienia z klasycznym ogniwem cynkowo-grafitowym, inaczej nic nie wyjdzie z "laboratoryjnego recyklingu". Wskazówką jest oznaczenie na obudowie. Jeśli zauważysz kod R03, R6, R14, R20, przystępuj do pracy (więcej o oznaczeniach ogniw w następnym odcinku).
Najpierw przygotuj stanowisko robocze. Potrzebna będzie taca (nie pobrudzisz wszystkiego wokół) i ochronne rękawice (unikniesz skaleczenia). Do rozbiórki ogniwa użyj obcęgów lub nożyc do metalu. Po zdjęciu ochronnej powłoki wykonanej ze stalowej blachy z naniesionymi informacjami, zobaczysz cynkowy kubeczek. Za pomocą kleszczy ostrożnie wyciągnij grafitowy pręcik, który może służyć jako elektroda. Nie usuwaj mosiężnej "czapeczki" z wierzchołka pręcika, ponieważ łatwo przylutujesz do niej przewód. Rozetnij cynkowy kubeczek i wyjmij jego zawartość. Masa wypełniająca ma konsystencję gęstego ciasta, a jej część znajdująca się w pobliżu wyciągniętej elektrody jest czarna i zawiera dwutlenek manganu wraz z pyłem grafitowym. Kubek zamyka krążek z tworzywa sztucznego lub warstwa smoły, co zapobiega wysychaniu zawartości. Cynkową blachę rozprostuj i starannie wyczyść. Ciemną masę zmieszaj z wodą, a po opadnięciu osadu na dno odsącz go i wysusz. W ten sposób otrzymasz dwutlenek manganu (domieszka grafitu nie przeszkadza w większości zastosowań MnO2) (5).
Pozostałości zanieś do punktu zbiórki zużytych baterii. Mam nadzieję, że zawsze tak postępujesz, a nie wyrzucasz niepotrzebnych chemicznych źródeł prądu (są one groźnym odpadem skażającym środowisko) do pojemników ze zwykłymi śmieciami komunalnymi. Pamiętaj, aby nie pozostawiać zużytych ogniw Leclanchégo w zasilanym urządzeniu.
Agresywne środowisko wewnętrzne niszczy powłokę, aż do jej całkowitego "przeżarcia", a wyciek elektrolitu może z kolei uszkodzić sprzęt elektroniczny (6). Pamiętaj również, że ogniwa jednorazowe nie nadają się do regeneracji i pod żadnym pozorem nie ładuj ich - wydzielające się produkty gazowe mogą rozerwać obudowę.
Dziś do pomiaru napięcia używamy woltomierza, ale uczeni radzili sobie także i bez tego przyrządu. Rolę miernika spełniał... język eksperymentatora! Nie do wiary? Sprawdź sam. Wystarczy bateria o napięciu 4,5 lub 9 V. Dotknięcie językiem mosiężnych blaszek spowoduje wyraźne szczypanie. Możesz sobie tylko wyobrazić (pod żadnym pozorem nie stosuj do prób źródła o większym napięciu!) doznania badaczy testujących baterie złożone z wielu metalowych płytek. Dotkliwie przekonał się o tym sam Napoleon Bonaparte. W początkach XIX wieku Francja rywalizowała z Anglią we wszystkich dziedzinach, nie tylko na polach bitew. Gdy sir Humphry Davy za pomocą elektrolizy otrzymał kilka nowych pierwiastków, Cesarz Francuzów (doceniający znaczenie nauki i techniki) ufundował paryskim uczonym baterię o napięciu przekraczającym 200 V, aby i oni mogli prowadzić badania. Pewnego razu odwiedził Sorbonę, chcąc przyjrzeć się działaniu nowego źródła prądu. Zanim ktokolwiek zdążył zareagować, Napoleon przytknął język do elektrod…
Krzysztof Orliński