Świat baterii - część 1

O uzasadnieniu przyznania nagrody obszerniej można przeczytać w poprzednim odcinku naszego chemicznego cyklu - a sam artykuł kończył się zapowiedzią dokładniejszego przedstawienia problematyki ogniw i baterii. Pora spełnić obietnicę.
Na początek krótkie wyjaśnienie nazewniczych nieścisłości.
Ogniwo to pojedynczy układ, który generuje napięcie.
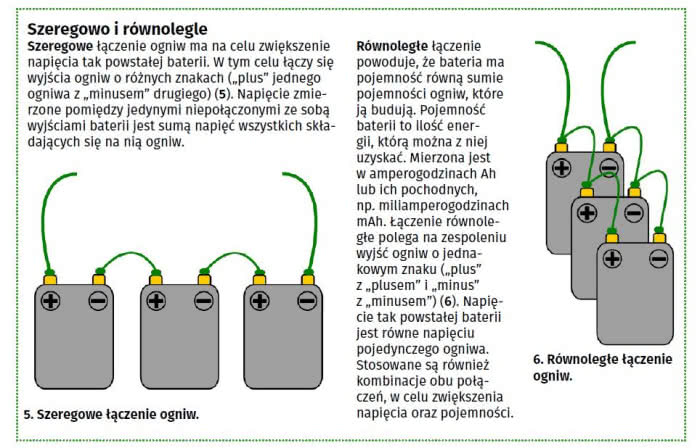
Bateria składa się z odpowiednio połączonych ogniw. Celem jest zwiększenie napięcia, pojemności (energii, którą można czerpać z układu) lub też obu tych wielkości razem.
Akumulator to zaś ogniwo lub bateria, które można naładować po wyczerpaniu. Nie każdy układ ma takie właściwości - wiele rodzajów jest jednorazowych. W potocznej mowie dwa pierwsze pojęcia często używane są zamiennie (w artykule również to się zdarzy), ale musimy mieć świadomość różnicy pomiędzy nimi (1).
Baterie i akumulatory nie są wynalazkiem ostatnich dekad, mają znacznie dłuższą historię. Być może słyszałeś już o doświadczeniach Galvaniego i Volty z przełomu wieków XVIII i XIX, które zapoczątkowały użycie prądu elektrycznego w fizyce i chemii. Jednak dzieje baterii zaczęły się jeszcze wcześniej. Było to dawno,…
…dawno temu w Bagdadzie
W roku 1936 niemiecki archeolog Wilhelm König znalazł w pobliżu Bagdadu gliniane naczynie, datowane na III wiek p.n.e. Znalezisko nie wydawało się niczym niezwykłym, zważywszy, że nad Eufratem i Tygrysem cywilizacja kwitła od tysięcy lat.
Zagadkowa była natomiast zawartość naczynia: skorodowany rulon miedzianej blachy, żelazny pręt oraz resztki naturalnej smoły. König głowił się nad przeznaczeniem artefaktu, aż przypomniał sobie wizytę na bagdadzkiej uliczce złotników. Tamtejsi rzemieślnicy używali podobnych konstrukcji do pokrywania metalami szlachetnymi miedzianych przedmiotów. Pomysł, że była to starożytna bateria, nie przekonał innych archeologów, twierdzących, że nie zachowały się żadne dowody użycia elektryczności w tamtych czasach.
Zatem Bateria z Bagdadu (tak nazwano znalezisko) to autentyk czy baśń z 1001 nocy? Niech rozstrzygnie eksperyment.
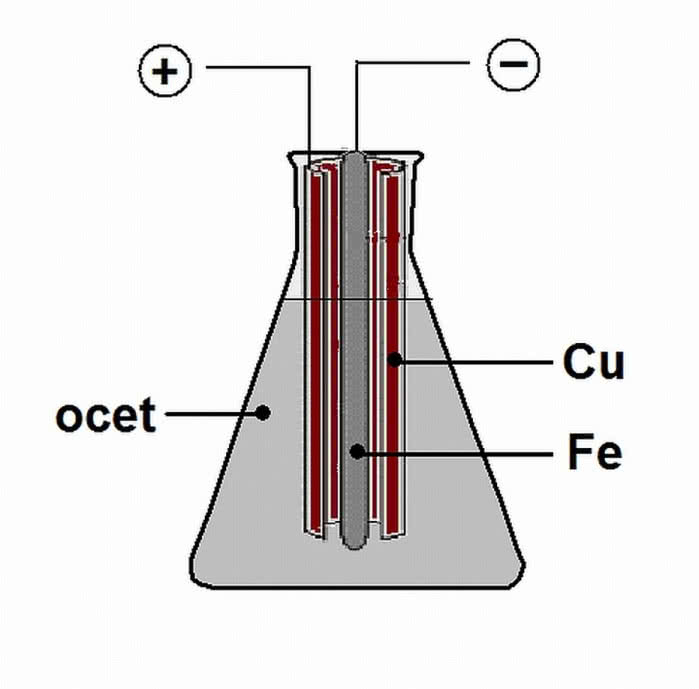
Potrzebne ci będą: miedziana blacha, żelazny gwóźdź oraz ocet (zauważ, że wszystkie te materiały były znane i powszechnie dostępne w starożytności). Smołę do uszczelnienia naczynia i jako izolację zastąp plasteliną.
Eksperyment przeprowadź w zlewce lub kolbie, choć użycie glinianego wazonika nada próbie posmaku autentyczności. Za pomocą papieru ściernego oczyść powierzchnie metali z nalotów i przytwierdź do nich przewody.
Blachę miedzianą zwiń w rulon i umieść w naczyniu, a do środka rulonu włóż gwóźdź. Przy pomocy plasteliny umocuj blachę i gwóźdź tak, aby się ze sobą nie stykały (2). Nalej octu do naczynia (roztwór o stężeniu ok. 5%) i za pomocą miernika uniwersalnego zmierz napięcie pomiędzy końcami przewodów połączonych z miedzianą blachą i żelaznym gwoździem. Przyrząd ustaw na pomiar prądu stałego. Który z biegunów stanowi "plus", a który "minus" źródła napięcia?
Miernik wskazuje 0,5-0,7 V, zatem Bateria z Bagdadu działa! Zauważ, że biegunem dodatnim układu jest miedź, a ujemnym - żelazo (miernik tylko w jednym wariancie połączenia przewodów z zaciskami wskazuje dodatnią wartość napięcia). Czy ze skonstruowanej repliki można czerpać prąd do użytecznej pracy? Tak, ale wykonaj jeszcze kilka modeli i połącz je szeregowo w celu zwiększenia napięcia. Dioda LED wymaga ok. 3 woltów - jeśli tyle uzyskasz ze swojej baterii, dioda zaświeci.
Bateria z Bagdadu była wielokrotnie sprawdzana pod kątem możliwości zasilania drobnego sprzętu. Podobny eksperyment wykonali również autorzy kultowego przed kilku laty programu "MythBusters". Pogromcy mitów (czy pamiętasz jeszcze Adama i Jamiego?) również doszli do wniosku, że konstrukcja mogła służyć jako starożytna bateria.
Czy zatem przygoda ludzkości z elektrycznością zaczęła się ponad 2 tysiące lat temu? I tak, i nie. Tak, ponieważ już wtedy była możliwa konstrukcja źródeł prądu. Nie, ponieważ wynalazek nie rozpowszechnił się - nie był wtedy i jeszcze przez wiele następnych wieków nikomu potrzebny.
Ogniwo? To proste!
Dokładnie oczyść powierzchnie blaszek lub drucików wykonanych z miedzi, aluminium, żelaza i cynku. W soczysty owoc (co ułatwi przepływ prądu) wbij próbki dwóch różnych metali tak, aby się ze sobą nie stykały. Zaciski miernika uniwersalnego połącz z końcami drutów wystających z owocu i odczytaj wartość napięcia pomiędzy nimi. Zmieniaj rodzaje użytych metali (a także owoce) i ponawiaj próby (3).
We wszystkich przypadkach powstały ogniwa. Wartości zmierzonych napięć różnią się w zależności od wziętych do eksperymentu metali i owoców. Połączenie owocowych ogniw w baterię pozwoli zasilić za jej pomocą drobny sprzęt elektroniczny (w tym przypadku wymagane jest niewielkie natężenie prądu, które możesz uzyskać ze swojej konstrukcji).
Końce drutów wystających ze skrajnych owoców połącz z przewodami, a te z kolei z końcówkami diody LED. Jeżeli tylko podłączyłeś bieguny baterii do odpowiednich "nóżek" diody i napięcie przekroczyło określony próg, dioda zaświeci (diody o różnych barwach mają odmienne napięcia startowe, ale ok. 3 woltów powinno wystarczyć).
Równie wdzięcznym obiektem do zasilenia jest zegarek elektroniczny - potrafi chodzić dość długo na "owocowej baterii" (choć wiele zależy też od modelu czasomierza).
Warzywa nie są gorsze od owoców i również dają możliwość zbudowania z nich baterii. Jak? Weź kilka kiszonych ogórków oraz odpowiednią liczbę blaszek lub drutów miedzianych i aluminiowych (te możesz zastąpić stalowymi gwoździami, ale uzyskasz niższe napięcie z jednego ogniwa). Skonstruuj baterię, a gdy użyjesz jej do zasilenia układu scalonego z kartki-pozytywki, ogórkowy "chórek" zaśpiewa!
Dlaczego akurat ogórki? Konstanty Ildefons Gałczyński twierdził, że: "Jeśli ogórek nie śpiewa, i to o żadnej porze, to widać z woli nieba prawdopodobnie nie może". Jak się jednak okazuje, chemik potrafi rzeczy, o których nawet poetom się nie śniło.
Biwakowa bateria
W awaryjnej sytuacji na biwaku sam możesz skonstruować baterię i zasilić nią diodę LED. Co prawda światło będzie nikłe, ale lepsze to niż jego brak.
Co ci będzie potrzebne? Oczywiście dioda, a poza tym foremka do kostek lodu, miedziany drut oraz stalowe gwoździe lub śruby (metale powinny mieć oczyszczone powierzchnie dla ułatwienia przepływu prądu). Potnij drut na kawałki i jednym z końców fragmentu owiń główkę śruby lub gwoździa. W ten sposób wykonaj kilka układów stal-miedź (8-10 powinno wystarczyć).
Do zagłębień w foremce nasyp wilgotnej ziemi (dodatkowo możesz zalać ją wodą z solą, co zmniejszy opór elektryczny). Teraz do zagłębienia włóż swoją konstrukcję: śruba lub gwóźdź musi znaleźć się w jednym otworze, a miedziany drut w drugim. Kolejne umieść tak, aby wraz z miedzią w jednym zagłębieniu znajdowała się stal (metale nie mogą się stykać). Całość tworzy szereg: stal-miedź-stal-miedź itd. Rozmieść elementy w taki sposób, aby pierwsze i ostatnie zagłębienie (jako jedyne zawierają pojedyncze metale) leżały obok siebie.
Nadchodzi moment kulminacyjny.
Jedną nóżkę diody włóż do pierwszego zagłębienia w szeregu, a drugą - do ostatniego. Świeci?
Jeśli tak, gratuluję (4)! Jeśli nie, poszukaj błędów. Dioda LED w przeciwieństwie do zwykłej żarówki musi mieć zachowaną biegunowość połączenia (czy wiesz, który z metali stanowi "plus", a który "minus" baterii?). Powinno wystarczyć odwrotne włożenie nóżek do ziemi. Inne powody niepowodzenia to zbyt niskie napięcie (minimum wynosi 3 wolty), przerwanie obwodu lub zwarcie w nim.
W pierwszym przypadku zwiększ liczbę elementów składowych. W drugim sprawdź połączenie pomiędzy metalami (ugnieć również ziemię wokół nich). W trzecim przypadku upewnij się, czy końcówki miedzi i stali nie stykają się ze sobą pod ziemią oraz czy ziemia lub roztwór, którym ją zwilżyłeś, nie połączyły sąsiednich zagłębień.
Eksperyment z "ziemną baterią" jest ciekawy i dowodzi, że elektryczność można uzyskać praktycznie "z niczego". Nawet jeśli nie zdarzy ci się konieczność użycia wykonanej konstrukcji, zawsze możesz zadziwić biwakowiczów swoimi umiejętnościami na miarę McGyvera (pamiętają go chyba tylko starsi technicy) lub mistrza surwiwalu.
Metal (elektroda) zanurzony w roztworze przewodzącym prąd (elektrolit) ładuje się względem niego. Minimalna ilość kationów przechodzi do roztworu, a elektrony pozostają w metalu. To, ile jonów znajdzie się w roztworze, a nadmiarowych elektronów w metalu, zależy od rodzaju metalu, roztworu, temperatury i wielu innych czynników. Jeśli w elektrolicie zostaną zanurzone dwa różne metale, powstanie napięcie pomiędzy nimi związane z odmienną liczbą elektronów. Gdy elektrody zostaną połączone przewodem, elektrony z metalu, w którym jest ich więcej (elektroda ujemna, czyli anoda ogniwa), zaczną przepływać do metalu, który ma ich mniej (elektroda dodatnia - katoda). Oczywiście podczas pracy ogniwa równowaga musi zostać zachowana: kationy metalu z anody przechodzą do roztworu, a elektrony dostarczane do katody reagują z otaczającymi ją jonami. Całość obwodu zamyka elektrolit umożliwiający transport jonów. Energię przepływających przewodem elektronów można wykorzystać do użytecznej pracy.
Krzysztof Orliński