Królewska rodzina. Wiecznie drugie (srebro) - część 1

Mowa jest srebrem, a milczenie złotem - nawet i przysłowia podkreślają jego drugorzędną rolę. Mityczny wiek srebrny nastąpił po szczęśliwym wieku złotym i przyniósł ludzkości pierwsze troski. Srebrny medal to nagroda za drugie miejsce, ale sportowcy mawiają, że drugi to pierwszy przegrany. Srebro nie ma łatwo w życiu.
Historia…
Srebro jest znane od tak dawna, jak jego rodzeństwo z góry i dołu grupy 11, czyli od czasów prehistorycznych. To ciężki metal o gęstości 10,5 g/cm3, a powierzchniowa warstwa skorupy ziemskiej zawiera go około 10-5% swojej masy (69 miejsce na liście rozpowszechnienia pierwiastków).
Srebro występuje w postaci samorodków i tą drogą trafiło w ręce ludzi. Ponieważ jest kowalne (blaszki mają grubość tysięcznej części milimetra, a z jednego grama można wyciągnąć drucik o długości 2 km - policz jego średnicę), dość odporne chemicznie i topi się w temperaturze możliwej do uzyskania nawet w prymitywnym palenisku (ok. 960°C), starożytni metalurgowie użyli go do produkcji ozdób, w której to roli pozostaje do dziś (1).
Najstarsze znane wyroby jubilerskie mają wiele tysięcy lat, a i obecnie ceniona jest srebrna biżuteria, często z charakterystycznym nalotem nadającym powab wiekowości. Drugim zastosowaniem była produkcja monet, dzisiaj już nie obiegowych, lecz kolekcjonerskich.
Ze srebra wykonywano kielichy, talerze i łyżki. W zamierzchłych czasach ginie odkrycie bakteriobójczych własności tego metalu, gdy zauważono, że ludzi używających srebrnych naczyń nie trapią choroby przewodu pokarmowego. Spowodowane jest to wysoce toksycznym wpływem srebra na drobnoustroje (i - jak wiadomo z popkultury - również na wampiry), a równocześnie niską toksycznością w stosunku do organizmów wyższych. Dawniej odkażano wodę wrzucając do niej rozgrzane srebrne monety, a i dziś srebrny przedmiot umieszczony we flakonie przedłuży życie ciętym kwiatom.
Już w starożytności samorodki srebra nie zaspokajały popytu na ten kruszec. Oprócz nielicznych minerałów, surowcem okazały się rudy ołowiu, w których występuje jako domieszka. Rzymianie jako pierwsi nauczyli się rozdzielać te dwa ważne metale i aż do średniowiecza było to główne źródło srebra. Odkrycie Ameryki z ogromnymi zasobami tego metalu spowodowało zwiększenie dostępności i spadek ceny. W wiekach XIX i XX srebro znalazło zastosowanie w powstałych wtedy fotografii oraz elektrotechnice i elektronice.
…i współczesność
Choć fotografia cyfrowa wyparła już tradycyjną technologię, pieniądze zastępuje karta płatnicza, a zastawa stołowa nie jest już wykonywana ze szlachetnych metali, na srebro nadal istnieje zapotrzebowanie. Styki elektryczne, przewody, ogniwa srebrowo- cynkowe to główne zastosowania we współczesnej technice. Nadal korzysta się również z jego bakteriobójczych właściwości, np. filtry do wody zawierają srebro osadzone w warstwie węgla aktywnego.
Nanosrebro to cząstki metalu o rozmiarach mniejszych niż 100 nm (0,0001 mm). Nanosi się je na przedmioty codziennego użytku, wyroby medyczne i odzież, co zapobiega rozwojowi szkodliwych drobnoustrojów. Srebro obecnie jest uzyskiwane głównie podczas produkcji ołowiu, cynku i miedzi, gdyż stanowi domieszkę ich rud. Dzięki temu największym producentem srebra w Europie i jednym z największych na świecie jest polska firma - KGHM (ponad 1400 ton w roku 2019) (2).
Nieco analityki
Od zawsze zadaniem chemików było otrzymywanie nowych substancji, ale również dociekanie, co kryje się w już istniejących (analiza jakościowa) i ile tego jest (analiza ilościowa). Dzięki stuleciom doświadczeń, opracowano tok postępowania, w którym w sposób systematyczny wykrywa się kationy i aniony obecne w badanej próbce. Analityka chemiczna podzieliła kationy na 5 grup w zależności od odczynnika, z którym reagują.
Srebro znajduje się w grupie pierwszej (m.in. z ołowiem) i jest wytrącane w postaci trudno rozpuszczalnego osadu przy pomocy kwasu solnego. Osad oddziela się i przeprowadza dalsze badania, a w pozostałym roztworze szuka innych składników.
Zanim przystąpisz do prób, zapoznaj się zasadami bezpiecznego posługiwania się związkami srebra. Do doświadczeń bezwzględnie używaj wody destylowanej lub dejonizowanej, którą dostaniesz np. na stacji benzynowej. Związki srebra ulegają łatwemu rozkładowi w kontakcie z substancjami organicznymi: skórą twoich dłoni, lnianym obrusem czy bawełnianym tiszertem. O ile czarne plamy z dłoni zejdą kilku dniach wraz ze złuszczającym się naskórkiem, o tyle obrus czy koszulka będą trwale naznaczone śladami twojej pracy (3).
Już alchemicy zauważyli ten fakt i nadali azotanowi(V) srebra AgNO3 (podstawowy związek tego metalu w laboratorium) miano "kamienia piekielnego" (łac. lapis infernalis, stąd potoczna nazwa związku - lapis) (4).
Przeprowadź kilka reakcji analitycznych. Do kilkuprocentowego roztworu AgNO3 dodaj nieco kwasu solnego HClaq o stężeniu 5-10%. Zlej ciecz znad osadu i podziel go na dwie części. Jedną pozostaw na świetle, do drugiej dodaj rozcieńczonego roztworu amoniaku NH3aq, a po rozpuszczeniu - roztworu kwasu azotowego(V) HNO3.
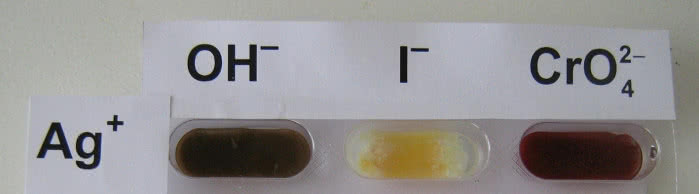
Dodatek kwasu solnego lub roztworu dowolnego rozpuszczalnego w wodzie chlorku powoduje natychmiastowe wytrącenie białego, serowatego osadu:
Ag+ + Cl- → AgCl ↓
Rozumiesz już dlaczego zalecałem użycie wody destylowanej. W "kranówce" obecne są rozpuszczone chlorki, które wytrącą osad lub spowodują zmętnienie roztworu. Pozostawiony na świetle osad rozkłada się z wydzieleniem wolnego metalu. Nie błyszczy on jednak, lecz ma szaroniebieską barwę z powodu wielkiego rozdrobnienia cząstek srebra (5). Osad rozpuszcza się w rozcieńczonym roztworze amoniaku (powstaje rozpuszczalny w wodzie związek kompleksowy). Gdy następnie zakwasisz roztwór przy pomocy HNO3 - osad znów się wytrąci (kwas rozłożył kompleks) (6).
Powstanie białego osadu pod wpływem chlorków, ciemniejącego na świetle, rozpuszczalnego w roztworze amoniaku i ponownie wytrącającego się pod wpływem kwasu azotowego, jest wystarczającym dowodem obecności jonów Ag+ w badanej próbce.
Podobne osady, jak w przypadku jonu chlorkowego, dają jego kuzyni - bromki i jodki (AgBr jest lekko żółtawej barwy, a AgI - jasnożółty). Jednak, w przeciwieństwie do AgCl, nie rozpuszczają się one w roztworze amoniaku. Wszystkie osady są natomiast rozpuszczalne w roztworze tiosiarczanu sodu Na2S2O3, co jest wykorzystywane w procesach utrwalania fotografii.
Rozkład chlorku, bromku i jodku srebra pod wpływem światła jest podstawą procesów fotograficznych, a równocześnie wielu interesujących doświadczeń z tej dziedziny. Skrótowo zostały one opisane w numerach 4 i 5 "Młodego Technika" z roku 2018 ("Magia fotografii"), a w pełni wyczerpująco - w książce pana Stefana Sękowskiego pt. "Fotochemia domowa".
Połączenia srebra są zwykle bezbarwne w roztworze (jeśli są rozpuszczalne) i białe w stanie stałym, o ile tylko anion nie jest barwny. Z pozostałych kolorowych związków znaczenie w analityce chemicznej ma czerwonobrunatny chromian(VI) srebra Ag2CrO4. Powstawanie tej barwy osadu jest również dowodem obecności chromianów w próbce. Barwny jest także tlenek srebra Ag2O. Jego brunatny osad powstaje nietypowo - w reakcji soli srebra z wodorotlenkami:
2Ag+ + 2OH- → Ag2O ↓ + H2O
Za taki przebieg reakcji odpowiada nietrwałość wodorotlenku srebra, który rozkłada się natychmiast po otrzymaniu (7).
Ołów, znajdujący się w tej samej grupie analitycznej, również daje biały osad chlorku, ale ten związek nie rozpuszcza się w roztworze amoniaku. PbCl2 jest za to dość dobrze rozpuszczalny w gorącej wodzie. W ten sposób oddziela się go od chlorku srebra i w powstałym roztworze przeprowadza próby analityczne dla ołowiu, np. powstawanie białego osadu PbSO4 w reakcji z rozpuszczalnymi siarczanami czy też złocistego PbI2 po dodaniu roztworu jodku potasu.
W podręcznikach chemii analitycznej znajdziesz również inne reakcje dla srebra. Przy okazji: wspomniane książki to istne kopalnie ciekawych doświadczeń, zwykle barwnych i dość prostych do wykonania.
Srebro to najbardziej błyszczący z metali, który w zakresie widzialnym odbija ponad 90% padającego promieniowania. Jego blask kojarzył się alchemikom z Księżycem, dlatego związali srebro z naszym satelitą. Jest stosowane do produkcji luster i - aby zapobiec ciemnieniu powierzchni - pokrywane warstwą szlachetnego rodu. Srebro to również metal o największym przewodnictwie elektrycznym i cieplnym. Jednak zazwyczaj w roli radiatorów stosuje się tańsze miedź lub aluminium (to ostatnie również jako powłokę luster), a niezawodnych styków w elementach elektronicznych - złoto, którego powierzchnia nie ulega zmianom.
Alchemiczne drzewko
Srebro znane jest od bardzo dawna, więc już alchemicy wykonywali z nim szereg eksperymentów. Jednym z nich było Drzewo Diany (srebro było metalem poświęconym bogini łowów). Do eksperymentu potrzebny jest miedziany drut oraz AgNO3. Drut oczyść z powierzchniowych nalotów i wygnij tak, aby przypominał drzewko z kilkoma konarami (lub - jak chcesz - w inny kształt). Wstaw drzewko do naczynia i zalej go 5 % roztworem lapisu. Na powierzchni miedzianych drucików w mgnieniu oka zaczynają wyrastać srebrzyste igiełki, nadające konstrukcji wygląd rośliny pokrytej szadzią. Bezbarwny roztwór stał się za to niebieski. Za zmianę koloru odpowiadają uwodnione jony miedzi, która - jako metal mniej szlachetny - przeszła do roztworu, wypierając z niego srebro (a to osadziło się na drucie) (8):
Cu + 2Ag+ → Cu2+ + 2Ag ↓
Otrzymany osad srebra możesz zeskrobać z powierzchni drutu i rozpuścić w roztworze kwasu azotowego( V). W ten sposób otrzymasz roztwór AgNO3 do dalszych doświadczeń. Unikaj jednak nadmiaru kwasu, a samo roztwarzanie wykonaj pod działającym wyciągiem lub na zewnątrz, ponieważ podczas reakcji wydzielają się szkodliwe tlenki azotu.
Nazwy kontynentów, państw, miast i rzek dały imiona wielu pierwiastkom, np. naszemu polonowi. Ale jeden z krajów zawdzięcza nazwę srebru. W XVI wieku konkwistadorzy odkryli wspólne ujście dwóch rzek do Atlantyku. Przyjemnie zaskoczeni znalezioną na lądzie ilością srebra, nadali rejonowi nazwę La Plata, czyli "srebrna". Po wyzwoleniu się spod hiszpańskiego panowania, mieszkańcy zdecydowali o przemianowaniu nazwy krainy na wersję łacińską. I tak powstała Argentyna.
Krzysztof Orliński