Na tropie izotopów - część 2
Czy Prout miał rację?
Wodór, ani żaden z pozostałych pierwiastków, nie wchodzi oczywiście w skład innego pierwiastka, byłoby to sprzeczne nawet z ówcześnie obowiązującą definicją (…substancja, której nie da się rozłożyć na prostsze metodami chemicznymi). Zatem w sensie formalnym hipoteza nie była prawdziwa. Spójrz jednak na zagadnienie z innej strony.
W czasie, gdy powstało pojęcie izotopu, wiedziano już, że jądro atomu jest naładowane dodatnio, a wokół znajdują się elektrony w liczbie pozwalającej na skompensowanie tego ładunku (atom jako całość jest elektrycznie obojętny). W XIX-wiecznych doświadczeniach z elektrolizą poznano również masę i ładunek jonu wodorowego.
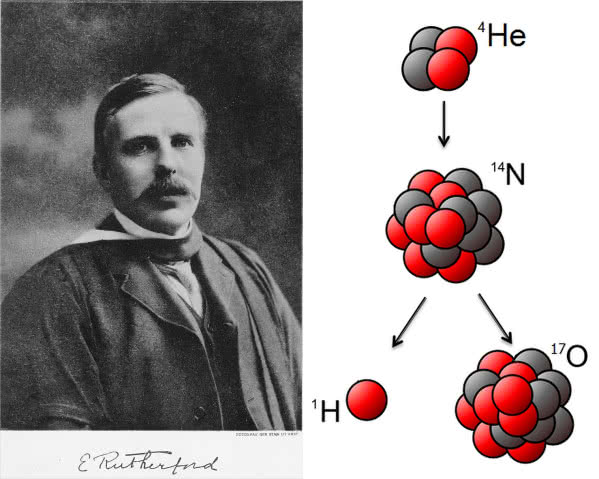
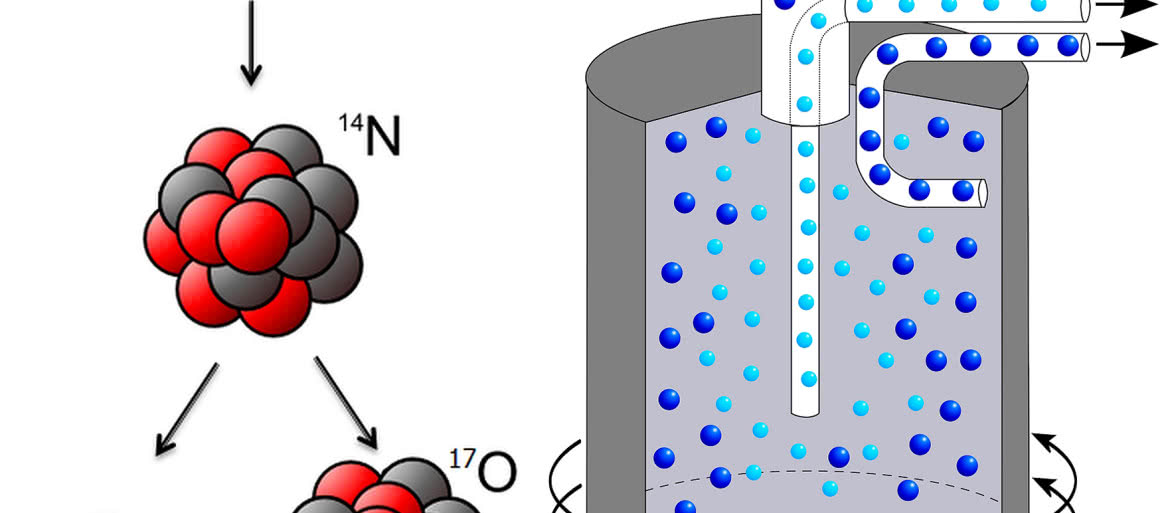
W roku 1919 Ernest Rutherford, odkrywca m.in. istnienia jądra atomowego, dokonał pierwszej sztucznej przemiany jądrowej. Rutherford przepuszczał cząstki a (jądra atomu helu-4) przez komorę wypełnioną azotem. Zauważył, że po trafieniu jądra atomu azotu przez cząstkę a tworzy się nowe jądro oraz zostaje wyemitowana inna cząstka, którą zidentyfikował jako jądro atomu wodoru (1). Brytyjski fizyk znał hipotezę Prouta i przez pewien czas wahał się, czy cząstce nadać nazwę prouton. Ostatecznie zdecydował się na proton (z gr. protos = pierwszy), a inspiracją był protyl, czyli uniwersalny budulec pierwiastków z hipotezy Prouta.
Można zatem stwierdzić, że w pewnym sensie pierwiastki zbudowane są z wodoru, ponieważ protony (jądra atomu wodoru, a ściślej jego najbardziej rozpowszechnionego izotopu) wchodzą w skład jąder wszystkich pierwiastków. Oczywiście istnieją również neutrony, których obecność w jądrach od razu stała się konieczna, skoro masa protonów wyznaczona na podstawie ładunku jądra była co najwyżej tylko połową masy atomowej.
Początkowo sądzono, że w jądrze znajdują się również elektrony zobojętniające ładunek nadmiarowych protonów. Potwierdzeniem miał być jeden z rodzajów rozpadu promieniotwórczego, w którym emitowane są właśnie elektrony. Po odkryciu neutronu i opracowaniu modelu budowy jądra atomowego, proton i neutron uważa się za dwie odmiany tej samej cząstki - nukleonu (łac. nucleus = jądro) - które w jądrze cały czas przechodzą w siebie nawzajem. Nie zapominaj również, że pierwiastki powstały i nadal powstają właśnie z wodoru, a miejscem ich narodzin są gwiazdy (2).
Drobne różnice
W początkach XX wieku stwierdzono, że izotopy są nieodróżnialne pod względem właściwości chemicznych. Jednak postępująca precyzja badań pozwoliła wykazać istnienie efektów izotopowych. Tym mianem określa się nieco odrębne właściwości izotopów pierwiastków w stanie wolnym i tworzonych przez nie związków. Zmiana masy i rozmiarów jądra pierwiastka powoduje zmiany poziomów energetycznych elektronów, a różnica ta decyduje o nieco odrębnych właściwościach chemicznych, np. szybkości reakcji i energii powstających wiązań. Efekty są jednak bardzo subtelne i przeważnie w ogóle nie ma potrzeby ich uwzględniać.
Właściwości fizyczne zależne od masy przejawiają się wyraźniej: temperatury wrzenia, szybkości ruchu i dyfuzji są odmienne dla izotopów tego samego pierwiastka. Podobnie jak w przypadku właściwości chemicznych, efekty izotopowe są bardziej zaznaczone dla lżejszych nuklidów - w ich przypadku dodanie jednego neutronu stanowi proporcjonalnie większy przyrost masy niż dla cięższych pierwiastków.
Różnice właściwości fizycznych i chemicznych izotopów wykorzystano do ich rozdzielania. Najczęściej stosowane metody to:
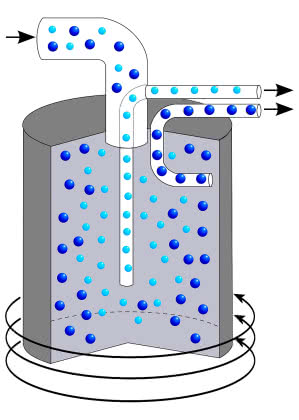
- spektroskopia mas polegająca na przepuszczaniu strumienia jonów przez pole magnetyczne lub elektryczne. Pod ich wpływem jony o różnych masach poruszają się w odmienny sposób i w efekcie trafiają w inne miejsca detektora. Spektroskopia masowa obecnie służy również do ustalania struktury związków organicznych (3).
- metody dyfuzyjne wykorzystujące różnice szybkości w ruchu cząstek o innych masach (lżejsze poruszają się szybciej), np. dyfuzja przez porowate membrany.
- odwirowanie wykorzystujące siłę odśrodkową mocniej działającą na cięższe cząstki (4).
- destylacja wykorzystująca różnicę temperatur wrzenia.
- jonizacja przez naświetlanie próbki odpowiednio dobranym promieniowaniem laserowym. Jony danego izotopu łatwo jest już oddzielić od obojętnej elektrycznie pozostałości.
- wzbogacanie chemiczne wykorzystujące odmienną szybkość przechodzenia danego izotopu do związku znajdującego się w stanie gazowym i w roztworze.
Izotopowe statystyki
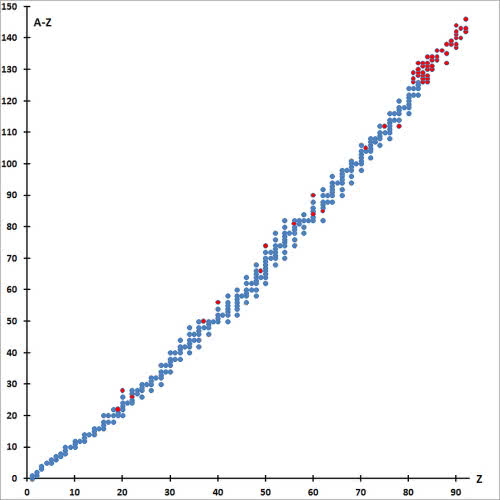
Spójrz na wykres zależności liczby neutronów od liczby protonów dla izotopów pierwiastków naturalnie występujących na Ziemi (patrz: Naturalne czy sztuczne?) (5). Znajduje się na nim ponad 300 nuklidów. Do ołowiu (liczba atomowa 82) większość jest stabilnych, ale i wśród nich zdarzają się promieniotwórcze. Jednak czasy ich życia są wystarczająco długie (minimum około miliarda lat), aby dotrwały do dziś od chwili powstania Ziemi. Długożyciowe są również niektóre cięższe pierwiastki: uran i tor oraz bizmut (w jego przypadku czas życia setki milionów razy przekracza wiek Wszechświat, czułość instrumentów pomiarowych musi być doprawdy imponująca, aby zarejestrować tak słabe promieniowanie).
protonów (Z) dla nuklidów naturalnie występujących na Ziemi
Izotopy pierwiastków o liczbach atomowych 84-89 i 91 istnieją tylko jako efekt zachodzących ciągle rozpadów długożyciowych izotopów uranu i toru. Na wykresie brak jest izotopów powstających w wyniku nielicznych, samorzutnych rozszczepień jąder uranu (promet i technet, a także neptun i pluton, których obecność również stwierdzono w przyrodzie) oraz powstających pod wpływem promieniowania komicznego (np. wodór-3 i węgiel-14).
Najbardziej rzuca się w oczy "ścieżka", na której położone są nuklidy. Dla pierwiastków lekkich (do wapnia) liczba neutronów jest w przybliżeniu równa liczbie protonów, dla cięższych widoczny jest nadmiar neutronów. To konsekwencja rosnących sił odpychania pomiędzy protonami, które muszą zostać zrównoważone jądrowymi siłami przyciągania działającymi pomiędzy nukleonami. Jednak powyżej ołowiu siły jądrowe nie mogą już przezwyciężyć odpychania jednoimiennych ładunków i wszystkie cięższe pierwiastki są promieniotwórcze.
Ciekawostką jest fakt, że nie istnieją trwałe izotopy sąsiadujących ze sobą pierwiastków o tej samej liczbie masowej - jeden z nich musi być promieniotwórczy, np. pomiędzy stabilnymi argonem-40 i wapniem-40 znajduje się promieniotwórczy potas-40.
Izotopy o pewnych liczbach neutronów i protonów mają zwiększoną trwałość i spotykane są w większej ilości. Liczby te - 2, 8, 20, 28, 50, 82, 126 i kilka innych - fizycy nazwali liczbami magicznymi. Przykłady: tlen-16 (8 protonów i 8 neutronów; izotop najbardziej rozpowszechniony na Ziemi), hel-4 (2 protony i 2 neutrony; cząstka a) czy też ołów-208 (82 protony i 126 neutronów; najcięższy trwały nuklid). Istnienie liczb magicznych jest dowodem na to, że nukleony w jądrze położone są na powłokach, podobnie jak elektrony w atomie.
Ile jest rodzajów wody?
Pytanie wydaje się być pozbawione sensu. Przecież już od końca XVIII wieku znamy prawo stałości składu związku chemicznego, z którego wynika m.in. że na świecie istnieje tylko jedna sól kamienna NaCl, jeden kwas siarkowy H2SO4 i oczywiście tylko jedna woda H2O. Ale jaka będzie odpowiedź, jeżeli uwzględnisz istnienie izotopów?
W początku lat 30. ubiegłego wieku Harold Urey, amerykański chemik specjalizujący się w problematyce rozdzielania izotopów, przeczuwał, że i wodór ma nie odkrytego do tej pory "bliźniaka" (6). Ponieważ izotop musiał być cięższy od zwykłego wodoru i w konsekwencji wrzeć w wyższej temperaturze, Urey powoli odparował ciekły wodór. W resztkach (z kilkulitrowej porcji pozostał tylko 1 cm3) znalazł izotop o masie atomowej wynoszącej 2.
Nagrodę Nobla w dziedzinie chemii
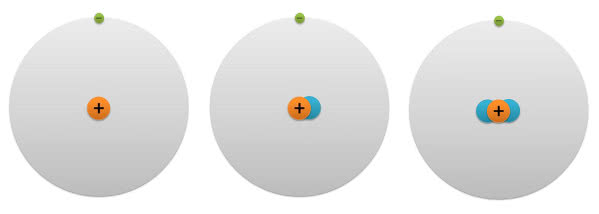
Zawartość ciężkiego wodoru jest śladowa i wynosi około 0,01%. W końcu lat 30. wyprodukowano jeszcze cięższy izotop o masie wynoszącej 3 jednostki, a później stwierdzono jego występowanie w przyrodzie jako produktu reakcji azotu atmosferycznego z cząstkami promieniowania kosmicznego. Izotopy wodoru, jako jedyne nuklidy, otrzymały własne nazwy i symbole chemiczne. I tak wodór-2 to deuter o symbolu D, wodór-3 to tryt o symbolu T, zaś dla zwykłego wodoru pozostawiono symbol H i nazwano go protem (wszystkie nazwy pochodzą od greckich liczebników porządkowych: pierwszy, drugi, trzeci) (7).
w skali ilustracji rozmiar atomu przekraczałby 100 metrów
W przypadku protu i deuteru różnica mas sięga aż 100 %, efekty izotopowe występują zatem bardzo wyraźnie. Ciężki wodór ma aż o kilka stopni wyższe temperatury topnienia i wrzenia oraz tworzy silniejsze wiązania niż lżejszy izotop.
Urey otrzymał również ciężką wodę, czyli D2O. I ten związek ma odmienne właściwości od zwykłej H2O. Wkrótce stwierdzono, że ciężka woda jest dobrym moderatorem (spowalniaczem) neutronów niezbędnych do przeprowadzenia rozszczepienia jąder uranu i podjęto jej produkcję. Urey uzyskał D2O przez wielokrotne odwirowywanie wody, ale stosowano również długotrwałą elektrolizę (lżejszy wodór wydziela się szybciej, metoda jest bardzo energochłonna - aby uzyskać 1 litr D2O należy rozłożyć ponad 100 ton wody), a obecnie wykorzystuje się różnice adsorpcji w kolumnach z odpowiednim wypełnieniem.
Wracając do pytania z początku rozdziału: w wodzie znajdują się nie tylko cząsteczki H2O i D2O, ale również mieszane HDO. Do tego dodaj jeszcze tryt, który również tworzy tlenek, oraz fakt, że tlen występuje w postaci trzech izotopów (16O, 17O i 18O). Ile zatem jest różnych rodzajów wody?
Człowiek wyprodukował już ponad 3000 różnych nuklidów, znacznie więcej niż początkowo istniało na Ziemi. Wiele z nich ma bardzo krótkie czasy życia, liczone nawet w ułamkach sekundy. W kilku przypadkach najpierw udało się otrzymać pierwiastki sztucznie, a potem stwierdzono, że ich śladowe ilości są obecne w przyrodzie (np. astat, neptun czy pluton). Do tego należy dodać działanie elektrowni jądrowych (a zwłaszcza uwolnienia izotopów promieniotwórczych w przypadkach awarii), izotopy wyprodukowane na cele medyczne i naukowe czy też efekty próbnych wybuchów bomb jądrowych i termojądrowych. Wszystkie te działania spowodowały wprowadzenie do środowiska izotopów, których pierwotnie w nim nie było. Wraz z rozwojem nauki i techniki zaciera się zatem granica pomiędzy naturalnym i sztucznym.
Krzysztof Orliński