Na tropie izotopów - część 3

Harold Urey, odkrywca ciężkiego izotopu wodoru - deuteru - oraz ciężkiej wody, stał się światowej sławy specjalistą w zakresie rozdzielania izotopów. Nie było więc zaskoczeniem, że i on został zaangażowany do największego przedsięwzięcia naukowego II wojny światowej o nazwie…
…Projekt Manhattan
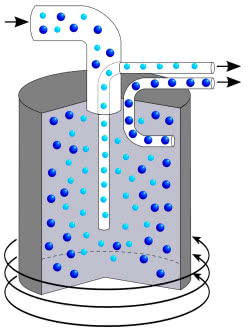
Podczas realizacji programu okazało się, że reakcję łańcuchową zapewnia izotop U-235. Jednak w naturalnym uranie znajduje się jedynie około 0,7% tego nuklidu. Ponadto cięższy izotop U-238 należało praktycznie całkowicie oddzielić, ponieważ pochłaniał on neutrony, co przerywało reakcję łańcuchową. Urey zdecydował, że najlepiej będzie przeprowadzić uran w lotny sześcio-fluorek UF6 i rozdzielić dwa rodzaje powstających cząsteczek (na szczęście dla generałów fluor występuje tylko w postaci jednego izotopu) za pomocą dyfuzji przez membranę z niewielkimi otworkami.
Stopień rozdziału zależy od pierwiastka kwadratowego z ilorazu mas i w tym przypadku wynosi około 1,004. Taka wartość oznacza, że pierwsze frakcje UF6 przenikające przez pory membrany są o 0,4% bogatsze w lżejsze cząsteczki. W celu osiągnięcia odpowiedniego stopnia rozdziału proces należy przeprowadzić kilka tysięcy razy, odpowiednio sterując strumieniami gazu (frakcje mniej wzbogacone zawraca się do wcześniejszych etapów). Obecnie do uzyskiwania U-235 najczęściej wykorzystuje się wydajniejszą metodę wirówkową, w której stopień rozdziału zależy od różnicy mas (1). Każdy z procesów jest jednak tak kosztowny i wymagający technologicznie, że tylko niewiele państw jest go w stanie przeprowadzić.
Ciężka woda również zapisała się w historii II wojny światowej. Amerykanie jako moderatora neutronów używali grafitu, Niemcy postawili na D2O. Jedyna w Europie fabryka ciężkiej wody znajdowała się w okupowanej Norwegii. Od roku 1942 alianci usiłowali zniszczyć urządzenia produkcyjne, aby przerwać niemiecki pro-gram atomowy. Ostatecznie udało im się to w 1944, a epizod wojenny znany jest jako "Bitwa o ciężką wodę".
Miliardy, miliony, …
Już w roku 1905 Ernest Rutherford stwierdził, że można określić wiek minerałów na podstawie zawartości w nich pierwiastków promieniotwórczych i produktów ich rozpadu. Oparł się na fakcie, że końcowym produktem przemian uranu i toru jest ołów, oraz na stałym okresie połowicznego zaniku promieniotwórczych atomów (patrz: Połowę mniej). Pierwsze pomiary dały wyniki sięgające, dla najstarszych badanych skał, ponad 2 miliardów lat, co od razu postawiło przed naukowcami dalsze pytania. Przede wszystkim były to kwestie rozwoju życia na Ziemi oraz energii pozwalającej Słońcu świecić przez tak długi czas z praktycznie niezmienną mocą.
Po odkryciu izotopów wiedziano już, które nuklidy są końcowymi produktami przemian promieniotwórczych, a zastosowanie spektrometrów masowych od połowy ubiegłego wieku pozwoliło na dużą precyzję oznaczeń. Oprócz metody podanej przez Rutherforda, w minerałach określa się zawartość helu (gaz ten jest wydzielany w wielu etapach przemian uranu i toru) i argonu (powstaje z promieniotwórczego potasu K-40) oraz stosunku strontu do rubidu (promieniotwórczy Rb-87 zamienia się w trwały Sr-87). Opracowano również kilka innych metod opartych na naturalnie występujących izotopach promieniotwórczych. Sposób datowania skał wybierany jest na podstawie ich składu chemicznego.
…i tysiące lat temu
Metody stosowane do datowania skał nie nadają się do określania wieku znalezisk archeologicznych. Po pierwsze, izotopy o czasie życia liczonym w miliardach lat po zaledwie tysiącach nie utworzą mierzalnych ilości produktów, a po drugie, pierwiastki ciężkie z reguły nie występują w materiale organicznym, np. drewnie. Rozwiązaniem okazało się użycie radioizotopu węgla powstającego w górnych warstwach atmosfery i stamtąd równomiernie rozprowadzanego w środowisku.
Na pomysł jego wykorzystania wpadł kolejny uczestnik Projektu Manhattan - amerykański chemik Willard Frank Libby (2). Promieniotwórczy izotop C-14 wbudowuje się w tkanki wraz ze zwykłym węglem, ulega w nich rozpadowi, ale ubytki są wyrównywane w procesach przyswajania związków węgla ze środowiska. Po śmierci organizmu (np. ścięciu drzewa) dopływ C-14 ustaje i następuje już tylko ubytek. Okres połowicznego rozpadu wynosi niespełna 5800 lat, co jest odpowiednią wielkością dla datowań znalezisk archeologicznych.
Libby wraz z zespołem musiał pokonać wiele trudności technicznych: zawartość radiowęgla jest śladowa (jeden atom C-14 na bilion atomów zwykłego węgla), a emitowane promieniowanie bardzo słabe. Należało opracować metody detekcji oraz przygotowania próbek tak, aby usunąć "obce" izotopy promieniotwórcze obecne w każdej tkance organicznej i nie zanieczyścić ich współczesnym materiałem większej zawartości C-14. Praca Libby'ego została nagrodzona chemicznym Noblem w roku 1960, natomiast sama metoda jest obecnie standardową procedurą badawczą w archeologii.
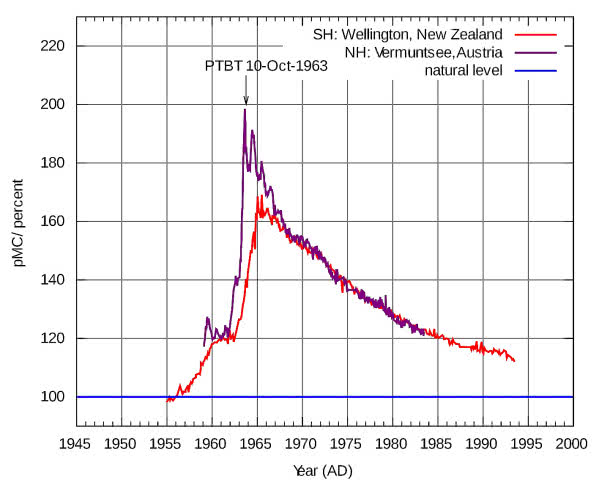
Na stężenie radiowęgla w atmosferze ma wpływ zmienna intensywność promieniowania kosmicznego. Jego poziom podniosły próbne wybuchy nuklearne i praca elektrowni atomowych, natomiast spalanie paliw kopalnych powoduje obniżenie zawartości C-14 (w węglach i ropie sprzed milionów lat występuje już tylko zwykły, nie promieniotwórczy węgiel). Wszystko to stwarza dodatkowe problemy podczas datowania (3).
Widoczny efekt częstych w latach 60. ubiegłego wieku naziemnych prób jądrowych
Jak ciepły był pradawny ocean?
Powszechnie uważa się, że skład izotopowy pierwiastków jest stały, niezależny od pochodzenia próbki (pociąga to również stałość masy atomowej). Jednak precyzyjne badania dowodzą, że istnieją pewne różnice, choć zazwyczaj nie ma potrzeby ich uwzględniania. Już w początkach XX wieku stwierdzono, że masy atomowe ołowiu pochodzącego z rud uranu i toru różnią się od siebie prawie o jednostkę (końcowymi produktami przemian są inne nuklidy Pb). Dla pierwiastków niezwiązanych z szeregami promieniotwórczymi odchylenia nie są aż tak wielkie.
Tlen składa się z trzech izotopów: dominującego O-16 oraz z ułamków procent O-17 i O-18. Proporcja O-18 do O-16 w wodzie zależy od temperatury. Woda z lżejszym izotopem tlenu paruje minimalnie szybciej, zatem w oceanie pozostaje więcej O-18 niż w deszczu spadającym nad lądami. Organizmy morskie korzystają więc z wody o nieco innym składzie izotopowym niż lądowe. Badając np. skamieniałe tkanki koralowców, można stwierdzić, jak ciepły był ocean, w którym żyły przed milionami lat (4). W przypadku organizmów lądowych proporcje izotopów tlenu odpowiadają składowi wody pitnej pochodzącej z opadów.
"zmierzyć" temperaturę wody, w której żyły (sylur, ok. 430 mln lat temu,
eksponat ze zbiorów Wrexham County Borough Museum w Walii,
autor: Wikimedia/Rept0n1x)
Rośliny w zależności od gatunku wykazują niewielkie różnice w przyswajaniu izotopów węgla i siarki, co również wpływa na skład izotopowy tkanek żywiących się nimi zwierząt, ludzi nie wyłączając. Precyzyjne analizy pozwalają stwierdzić, czy nasza dieta złożona jest z produktów lokalnych, czy też jemy dużo żywności pochodzącej z tropików.
W służbie medycyny…
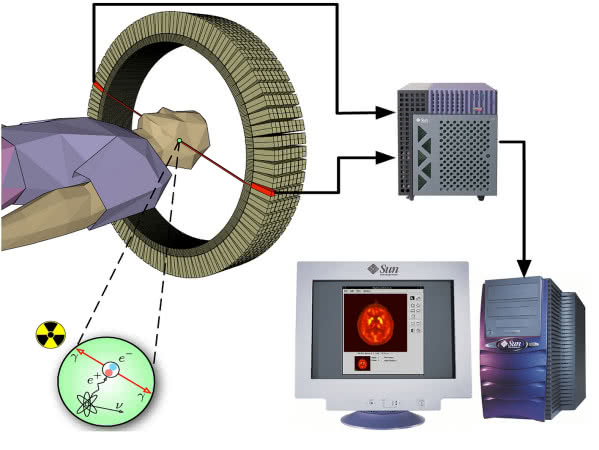
Radioizotopy w medycynie muszą spełniać szereg restrykcyjnych warunków: gromadzić się w badanym organie, emitować łatwo wykrywalne, a przy tym mało szkodliwe dla organizmu promieniowanie, ich czas życia powinien być na tyle krótki, aby po badaniu szybko uległy rozpadowi. Jednym z podstawowych izotopów stosowanych w diagnostyce medycznej jest technet-99, nuklid niewystępujący naturalnie na Ziemi. Ma on szczególne powinowactwo do tkanki nowotworowej i dzięki rejestracji jego promieniowania można uzyskać "mapę" narządów, na której widać podejrzane ogniska (5). Radioizotopów potasu i żelaza używa się do badań krwi, wapnia - kości, a jodu - tarczycy. Są to zatem pierwiastki obecne w tych narządach w znacznych ilościach.
w diagnostyce nowotworów: emisja pozytonów powoduje ich anihilację,
w rezultacie czego powstaje promieniowanie gamma wykrywane przez aparaturę
…i chemii
Nuklidy promieniotwórcze używane są jako wskaźniki izotopowe umożliwiające - poprzez pomiar promieniowania substratów i produktów - śledzenie dróg przemiany danego pierwiastka w toku reakcji chemicznych. W celach analitycznych stosuje się aktywację neutronową, czyli naświetlanie próbki za pomocą neutronów, które powodują powstanie określonych izotopów promieniotwórczych. Tym sposobem można oznaczyć nawet śladową zawartość danego pierwiastka.
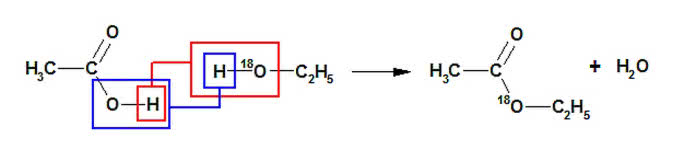
Również zwykłe, trwałe nuklidy pomagają w badaniu przebiegów reakcji chemicznych, w tym i zachodzących w komórkach organizmów żywych. Obecny poziom techniki eksperymentalnej umożliwia wstawienie np. deuteru czy ciężkiego izotopu tlenu w określone miejsce cząsteczki. Po reakcji wystarczy oznaczyć masy atomowe produktów, aby wiedzieć, jaki jest mechanizm przemiany (6). Wymiana wybranego atomu na jego izotop pozwala również na rozszyfrowanie skomplikowanych widm związków chemicznych (izotopy absorbują promieniowanie o innych długościach fali). Najczęściej zastępuje się zwykły wodór deuterem, ponieważ te nuklidy najbardziej różnią się właściwościami.
I to już koniec przeglądu ciekawszych informacji izotopach, ich pasjonującej historii i zastosowaniach. Nie są one już domeną tylko fizyków, przeciwnie - stały się nieodzowną częścią również i innych nauk, chemii nie wyłączając.
Krzysztof Orliński
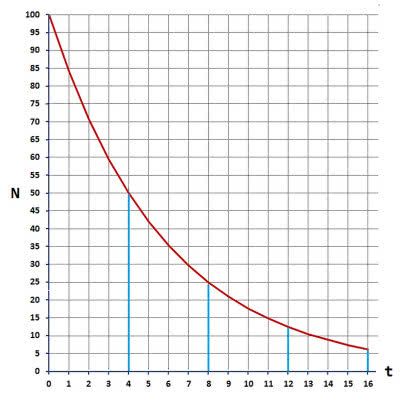
Okres połowicznego zaniku (rozpadu) lub okres półtrwania to czas, po którym pozostanie połowa początkowej ilości pierwiastka promieniotwórczego. Przykład: okres połowicznego zaniku radonu-222 wynosi w przybliżeniu 4 dni. Oznacza to, że po 4 dniach w próbce o masie początkowej 1 mg pozostanie 0,5 mg Rn-222. Po kolejnych 4 dniach już tylko 0,25 mg, a po następnym czterodniowym okresie - 0,125 mg, itd. (7). Jak zatem często błędnie się uważa, pierwiastek promieniotwórczy nie zniknie całkowicie po dwóch okresach połowicznego rozpadu. Okresy półtrwania są skrajnie zróżnicowane: od czasu miliony razy przewyższającego wiek Wszechświata do ułamków milisekund. Wielkość ta ma również wpływ na możliwości wykrycia promieniowania danego nuklidu. Przyjmuje się, że po upływie 10 okresów połowicznego zaniku praktycznie już nie ma izotopu promieniotwórczego, a w przypadku jego niewielkiej początkowej zawartości - nawet krócej.
Średni czas życia pierwiastka promieniotwórczego określa się jako wielkość w przybliżeniu 1,44 razy większą od okresu połowicznego zaniku. Takie same zależności matematyczne obowiązują również dla innych zjawisk, np. zmian temperatury ciała podczas jego stygnięcia, rozładowania kondensatora, szybkości wielu reakcji chemicznych czy też wydalania leków z organizmu.