Wcale nie takie rzadkie - część 2

Chude lata
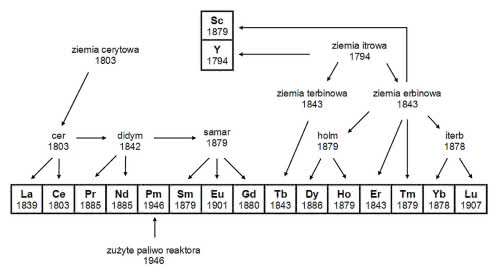
W poprzednim odcinku dzieje pierwiastków ziem rzadkich zatrzymały się w roku 1843. Przez kilka dziesięcioleci w ich chemii nic się nie działo, a powodem był brak surowców - występowały tylko w nielicznych, trudno dostępnych minerałach. Oprócz bastnazytu i gadolinitu, był to również znaleziony na Uralu samarskit (1).
wielu lantanowców (kolekcja minerałów Brigham Young University,
Department of Geology, Provo, Utah, USA)
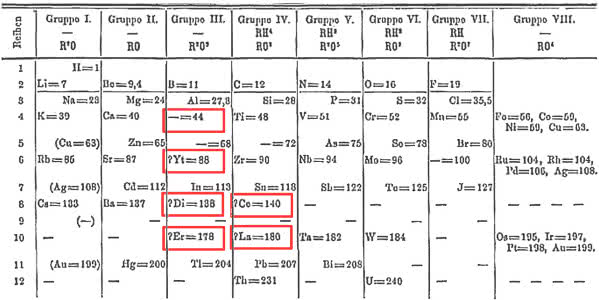
W roku 1869 Mendelejew przedstawił pierwszą wersję układu okresowego pierwiastków. Miał szczęście, że znano tylko kilka metali ziem rzadkich (itr, lantan, cer, didym, erb i terb) i udało się dla nich znaleźć miejsce w tablicy. Kłopoty jednak miały dopiero nadejść (2).
i przewidywanym ekaborem (skandem)
W roku 1859 naukowcy dostali do rąk potężne narzędzie. Chemik Robert Bunsen i fizyk Gustav Kirchhoff skonstruowali spektroskop. Dzięki niemu możliwa stała się analiza światła emitowanego przez substancje umieszczone w płomieniu palnika. W tych warunkach ulegają one rozpadowi na atomy, a każdy pierwiastek emituje charakterystyczne dla siebie promieniowanie - niepowtarzalny zestaw linii widmowych. Bunsen i Kirchhoff od razu potwierdzili przydatność swojej konstrukcji, odkrywając rubid i cez na podstawie obserwacji ich widm.
Kalendarium część 2
1878. W USA odkryto znaczne złoża samarskitu i od tej pory badacze nie narzekali już na brak surowca. Szwajcarski chemik Jean de Marignac wydzielił z niego ziemię erbinową i ponownie ją przeanalizował. W tlenku erbu stwierdził obecność nowego metalu. Był to iterb, któremu nazwę po raz kolejny, czwarty już, nadała kopalnia w Ytterby (3).
w gadolinicie pochodzącym z jej złóż (autor: Uwezi\Wikimedia)
1879. To był bardzo dobry rok dla metali ziem rzadkich - na świecie pojawiło się aż cztery z nich. Lars Nilson również badał widmo ziemi erbinowej i zauważył w niej linie nieznanego pierwiastka. Szwedzki chemik wydzielił jego tlenek i określił właściwości metalu. Okazały się zdumiewająco podobne do ekaboru przewidzianego kilka lat wcześniej przez Mendelejewa. Odkrycie stanowiło mocny argument potwierdzający prawo okresowości, a nowy pierwiastek otrzymał nazwę skand (łac. Scandia = Skandynawia).
Per Cleve, inny szwedzki chemik, także analizował ziemią erbinową. Po oddzieleniu tlenków znanych metali znalazł jeszcze dwa nowe pierwiastki. Był to holm (łac. Holmia = Sztokholm) i tul (Thule to starożytna i średniowieczna nazwa północnej części Skandynawii). Inni badacze donieśli o kilku dalszych pierwiastkach, ale okazały się one mieszaninami już znanych lantanowców.
Nie spudłował za to francuski chemik Paul-Émile Lecoq de Boisbaudran. Po przeprowadzeniu analizy widma didymu otrzymanego z samarskitu stwierdził w nim obecność obcych linii spektralnych. Wyodrębnił tlenek nowego pierwiastka i nadał mu nazwę samar (od minerału, w którym go odkrył).
1880. Po raz kolejny Jean de Marignac zauważył w widmie samarskitu linie należące do nieznanego pierwiastka. Udało mu się wydzielić jego tlenek, a metal w nim zawarty - gadolin - otrzymał imię na cześć Johana Gadolina, odkrywcy pierwszego metalu ziem rzadkich.
1885. Zakończyło się życie didymu. Austriacki chemik i wynalazca Carl Auer von Welsbach rozdzielił jego tlenek na dwa nowe związki. Metale znajdujące się w tlenkach nazwał początkowo prazeodidymem i neodidymem („zielony bliźniak” i „nowy bliźniak”), ale wkrótce uproszczono nazwy i dziś mamy prazeodym i neodym. Uczony naruszył jednak niepisaną konwencję wynikającą z szacunku dla pracy poprzedników. Do tej pory chemik, który w już znanym pierwiastku odkrywał inny, zachowywał nazwę starego metalu, a nową nadawał odkrytemu przez siebie (pierwiastki więc nie „ginęły”, ale „wydawały” potomstwo).
1886. Po wielu latach badań Lecoq de Boisbaudran mógł wreszcie stwierdzić, że w tlenku holmu kryje się jeszcze jeden pierwiastek. Jednak nie powiodły się próby ich rozdzielenia (udało się to dopiero w początkach XX wieku). Trudności zostały uwiecznione w nazwie metalu - dysproz z greckiego znaczy „trudny do otrzymania”.
1901. W widmie samaru znajdowały się linie spektralne nieznanego pierwiastka, jednak dopiero po ponad 10 latach pracy francuski chemik Eugène-Anatole Demarçay zdołał wydzielić nowy tlenek w czystej postaci. Metal otrzymał nazwę europ (4).
1907. Dwaj chemicy równocześnie rozłożyli tlenek iterbu na składniki. Auer von Welsbach nazwał je aldebranem i kasjopem (od nazw gwiazdy oraz gwiazdozbioru), natomiast Georges Urbain jednemu pierwiastkowi pozostawił nazwę iterb, a drugiemu nadał imię lutet (łac. Lutetia = Paryż). Przyjęły się nazwy zaproponowane przez francuskiego chemika - najwyraźniej Auerowi nie zapomniano „uśmiercenia” didymu.
1946. Od ponad 30 lat zdawano sobie sprawę, że brakuje jeszcze jednego lantanowca. Lata systematycznych badań i drobiazgowych analiz znanych związków metali ziem rzadkich nie przyniosły jednak rezultatów, zaś rozwój atomistyki dowiódł, że nie istnieje żaden stabilny izotop tego pierwiastka. Promet (tak został nazwany na cześć mitycznego Prometeusza) wydzielono ze zużytego w reaktorze paliwa jądrowego. Odkrywcami stali się amerykańscy chemicy pracujący w Oak Ridge National Laboratory (Tennessee w USA): Jacob Marinsky, Lawrence Glendenin i Charles Coryell. Nowoczesne metody analityczne pozwoliły stwierdzić obecność śladowych ilości prometu w przyrodzie, gdzie występuje jako produkt nielicznych, samorzutnych rozszczepień jąder uranu (5).
Chemia metali ziem rzadkich
Skand, itr i lantanowce mają srebrzystoszarą barwę, są dość miękkie i kowalne (6). Jak przystało na pierwiastki grupy trzeciej, ich wartościowość wynosi przeważnie III, a tylko w nielicznych przypadkach jest inna: IV (cer i terb) lub II (europ i iterb). Wszystkie one są metalami o dość dużej aktywności, porównywalnej z aktywnością magnezu. Na powietrzu pokrywają się warstwą tlenku, a ogrzane do temperatury około 200ºC gwałtownie płoną. Ich tlenki nie rozpuszczają się w wodzie ani w zasadach, ale ulegają działaniu kwasów. W postaci metalicznej na gorąco rozkładają wodę z wydzieleniem wodoru (powstają wodorotlenki). Reagują z rozcieńczonymi kwasami, tworząc odpowiednie sole, ale stężony kwas azotowy i siarkowy powodują ich pasywację (pokrywają się szczelnymi, nierozpuszczalnymi warstwami tlenków, które chronią je przed dalszym wpływami otoczenia - podobnie jak ma to miejsce w przypadku wyrobów z aluminium). Z popularnych soli fluorki, węglany, fosforany i szczawiany lantanowców są trudno rozpuszczalne, a chlorki, azotany i siarczany - łatwo (rozpuszczalność jest podobna do soli glinu). Wodorotlenki są trudno rozpuszczalne i nie roztwarzają się w roztworach zasad (to z kolei podobieństwo do wapniowców).
na zdjęciu próbka ceru (https://images-of-elements.com)
Ten krótki przegląd właściwości chemicznych metali ziem rzadkich powinien cię przekonać, że Johan Gadolin już w roku 1794 trafnie określił je jako zbliżone do właściwości związków glinu oraz wapnia.
Kłopoty z zameldowaniem
Rosnąca liczba odkrywanych lantanowców wcale nie cieszyła Mendelejewa i chemików zajmujących się klasyfikacją pierwiastków. Zdawały się one podważać prawo okresowości. Niewiele różniące się masy atomowe lantanowców wymagały ustawienia ich w jednym szeregu, obok siebie. Ale sąsiadujące pierwiastki musiały, zgodnie z prawem okresowości, znajdować się w różnych grupach i oczywiście mieć inne właściwości i wartościowość. Tymczasem lantanowce miały prawie takie same właściwości chemiczne i wartościowość zawsze równą III (z kilkoma wyżej wspominanymi wyjątkami). To zaś sugerowało, że muszą znaleźć się w tej samej grupie. Przez pewien czas uważano je nawet wszystkie za jeden pierwiastek w różnych odmianach. Problem z ulokowaniem lantanowców w tablicy Mendelejewa podważał zaufanie chemików do prawa okresowości. Dopiero osiągnięcia nauki o budowie atomu i rozwój mechaniki kwantowej w latach 20. i 30. XX wieku wyjaśniły ich położenie w układzie okresowym.
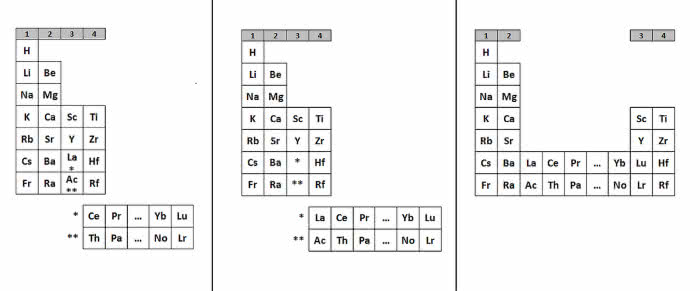
Miejsce zameldowania lantanowców do dziś jednak stanowi przedmiot sporów i dyskusji w świecie chemików. W XIX wieku umieszczano je wszystkie w jednej „kratce” układu okresowego, w grupie trzeciej (lokalizacja w tej grupie była oczywista ze względu na wartościowość i podobieństwo do skandu i itru). W kolejnym stuleciu lantanowce najczęściej wyodrębniano w osobny szereg położony pod całym układem (7).
Rozstrzygnięcia wymaga również to, od którego pierwiastka zaczynają się lantanowce i na którym kończą. Najczęściej lantan, choć dał nazwę całej rodzinie, do niej nie należy - jest skandowcem z grupy trzeciej, a lantanowce to metale od ceru do lutetu. Jednak analiza właściwości fizycznych, charakteru chemicznego tworzonych związków i obserwowane tendencje zmian w układzie okresowym sugerują, że do grupy 3. bardziej pasuje ostatni z nich - lutet. Tym sposobem lantanowce to pierwiastki od lantanu do iterbu. Metale ziem rzadkich nadal stanowią zagadkę dla badaczy, a w ich chemii wiele jeszcze pozostało do odkrycia.
Nawet obecnie rozdzielanie związków metali ziem rzadkich należy do najbardziej skomplikowanych operacji w technologii chemicznej. Oto krótki przegląd stosowanych metod.
Krystalizacja frakcjonowana, która była używana już przez odkrywców, polega na wykorzystaniu różnic w rozpuszczalności soli lantanowców. Po krystalizacji osad zostaje wzbogacony w składnik trudniej rozpuszczalny, natomiast roztwór - w łatwiej. Wielokrotne powtórzenie procesów krystalizacji, rozpuszczania i ponownej krystalizacji pozwala uzyskać wysoki stopień rozdziału.
Frakcjonowane wytrącanie osadów wykorzystuje różnice w rozpuszczalności osadów (zwykle wodorotlenków). Rozpuszczenie osadu i ponowne wytrącenie pozwala uzyskać wzbogacenie osadu w składnik trudniej rozpuszczalny, a roztworu - w łatwiej.
Chromatografia jonowymienna polega na przepuszczeniu roztworu soli lantanowców przez kolumnę wypełnioną syntetyczną żywicą, która ma zdolność do wymiany kationów na jon wodorowy. Lżejsze jony lantanowców są wiązane przez żywicę mocniej niż cięższe. Podczas wymywania (przez kolumnę przepuszcza się odpowiednio dobrany rozpuszczalnik) kationy uwalniane są w kolejności odwrotnej: najpierw cięższe, potem lżejsze.
Ekstrakcja wykorzystuje różnice rozpuszczalności związków w dwóch niemieszających się cieczach - w wodzie oraz w rozpuszczalniku organicznym.
Krzysztof Orliński