To już 150 lat - część 2. Osiągnięcia Meyera, Mendelejewa
Podejmowane próby usystematyzowania układu pierwiastków nie przynosiły wyników lub szły w zapomnienie (patrz poprzedni odcinek), aż dwaj chemicy, którzy prowadzili wykłady z chemii ogólnej, postanowili napisać podręczniki dla swoich studentów. W jakiej kolejności omówić znane pierwiastki? Należało dokonać ich klasyfikacji, aby układ treści był logiczny (1).
Układ Meyera
Pierwszym, który spostrzegł, że pierwiastki ułożone według wzrastających mas atomowych wykazują okresowe podobieństwo własności chemicznych i fizycznych (tak brzmiało prawo okresowości), był niemiecki chemik Lothar Meyer. Nie zdobył jednak sławy odkrywcy, ponieważ jego układ był… kompletny. Ten paradoks stanie się zrozumiały, gdy porównamy go z tablicą Mendelejewa.
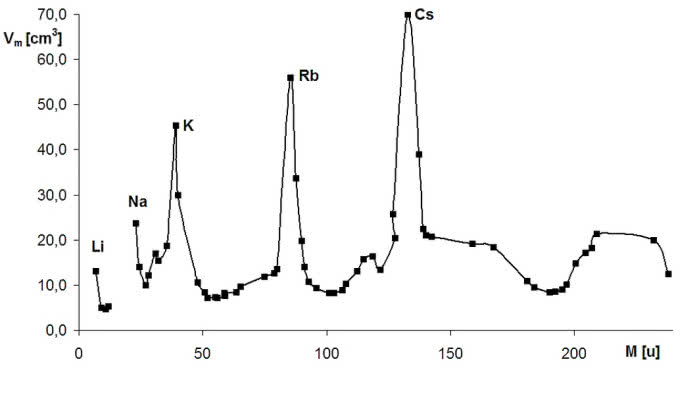
Meyer nie zostawił miejsca na nieznane jeszcze pierwiastki, a nawet pominął kilka już istniejących, ponieważ nie pasowały swoimi właściwościami do miejsc, w których powinny się znaleźć. Co więcej, sporządził swoją tablicę wcześniej, ale opublikował odkrycie dopiero wtedy, gdy znano już dokonania Rosjanina - niewątpliwe osiągnięcia Meyera przyczyniły się tylko do utrwalenia pierwszeństwa jego konkurenta. Podana przez niego zależność objętości molowej (objętość jednego mola) od masy atomowej stanowiła doskonałą ilustrację periodycznego charakteru własności pierwiastków (2). Wiele innych własności wykazuje również podobną zależność (spróbuj samodzielnie wykonać wykresy).
Wielki dzień Mendelejewa
Legenda głosi, że Dymitr Mendelejew stale nosił przy sobie karteczki z danymi dotyczącymi 63 znanych wtedy pierwiastków i bez końca układał "chemicznego pasjansa". Czy tak było - nie wiadomo, ale na pewno długo myślał nad tym zagadnieniem. W dziejach nauki mało jest tak dobrze udokumentowanych odkryć. Z zachowanych szkiców wynika, że Mendelejew rozpoczął pracę rankiem 1 marca 1869 r. (w Rosji, gdzie obowiązywał wtedy kalendarz juliański, był to 17 lutego). Po kilku godzinach prób uciął sobie drzemkę, a wkrótce potem układ był gotowy (czy mu się przyśnił?). Natychmiast rozesłał odbitki tablicy do wielu znanych chemików i niebawem kolejne wersje ukazały się w czasopismach chemicznych. Forma tablicy różniła się od współczesnej, ale ogólny zarys jest i dziś zrozumiały dla każdego chemika (3).
Wnioski, które Mendelejew wyciągnął ze swojego odkrycia, w pełni upoważniają go do dzierżenia palmy pierwszeństwa. Skorygował kilka błędnie wyznaczonych wartościowości i mas atomowych (np. berylu czy uranu) i umieścił te pierwiastki w odpowiednich grupach. W przypadku telluru i jodu oraz kobaltu i niklu zmienił kolejność wynikającą z ich mas atomowych tak, aby również one znalazły się we właściwych miejscach (uważał, że błędnie wyznaczono ich masy, lecz podejmowane próby sprawdzenia nie przyniosły rezultatów).
Największym osiągnięciem Mendelejewa było jednak pozostawienie luk w układzie, które miały zająć nieodkryte jeszcze pierwiastki, oraz określenie ich właściwości.
Sukcesy…
Mendelejew zaangażował się w propagowanie prawa okresowości: występował z wykładami i prowadził ożywioną korespondencję z najsłynniejszymi chemikami. Jednak nie tylko ta reklamowa działalność odkrywcy przesądziła o sukcesie układu okresowego - połączył on rzeczywiście podobne pierwiastki w grupach, m.in. o tej samej wartościowości i analogicznych własnościach tworzonych związków. Wkrótce układ Mendelejewa stał się podstawowym narzędziem pracy chemików oraz doskonałym środkiem nauczania tego przedmiotu.
W ciągu następnych lat Mendelejew stale wprowadzał poprawki do swojej tablicy, a odkrycia przepowiadanych przez niego eka-boru (skand, 1879), eka-glinu (gal, 1875) oraz eka-krzemu (german, 1886) wzbudziły słuszny podziw wśród chemików. W przypadku galu Mendelejew zwrócił się nawet do odkrywcy tego pierwiastka, aby ten sprawdził niektóre własności nowego metalu, ponieważ nie zgadzały się z jego teoretycznymi przewidywaniami. Po wykonaniu ponownych badań okazało się, że rację miał Mendelejew!
Należy jednak dodać, że wprawdzie niektóre z pozostałych przewidywań potwierdziły się (np. pod tellurem znalazł miejsce polon, którego własności dobrze odpowiadały mendelejowowskiemu dvi‑tellurowi), to inne jednak nie (4).
… i zagrożenia
Lantanowce od początku spędzały sen z powiek chemików. Całe szczęście, że w roku 1869 znano zaledwie kilka z nich i dało się je umieścić wśród pozostałych pierwiastków. Jednak wraz z odkrywaniem kolejnych pojawił się poważny problem: lantanowce nieznacznie różniły się masą atomową (wobec czego w układzie musiały leżeć obok siebie), ale ich wartościowość prawie zawsze wynosiła trzy. Zaprzeczało to prawu okresowości, które wymagało, aby sąsiadujące ze sobą pierwiastki znajdowały się w różnych grupach i miały różne wartościowości.
Problem nie został rozwiązany aż do śmierci Mendelejewa - najczęściej umieszczano je wszystkie w jednej "kratce" układu, a wyjaśnienie przyniósł dopiero współczesny model budowy atomu. Trudności z klasyfikacją lantanowców spowodowały nawet pojawienie się licznych głosów kwestionujących prawdziwość samego prawa okresowości.
W roku 1868 zaobserwowano hel w widmie Słońca, ale Mendelejew nie uznał pierwiastka, którego nie znaleziono na Ziemi. W latach 90. XIX w w powietrzu odkryto jednak całą rodzinę gazów szlachetnych. Istnienie pierwiastków niewchodzących w żadne reakcje chemiczne również wydawało się zaprzeczać samemu prawu okresowości. Z dylematu wybrnięto, tworząc dla helowców specjalną grupę pierwiastków zerowartościowych (przy okazji pojawił się problem następnej nieprawidłowej pary: argon - potas).
Odkrycie zjawiska promieniotwórczości, choć w konsekwencji wyjaśniło samo prawo okresowości, także zagroziło dziełu Mendelejewa. W krótkim czasie zidentyfikowano kilkadziesiąt substancji mających odmienne właściwości promieniotwórcze.
Niektóre z nich wykazywały te same właściwości chemiczne mimo różnych mas atomowych, inne zaś, o jednakowych masach - różne. Ponadto w rejonie tablicy, w którym powinny się znaleźć ze względu na wartości mas atomowych, nie było aż tylu pustych miejsc, aby pomieścić je wszystkie. Lawina odkryć groziła pochłonięciem całego układu.
Wyjaśnienie prawa okresowości
Sam Mendelejew podejrzewał, że okresowość właściwości pierwiastków jest odbiciem wewnętrznej struktury ich atomów. W roku 1910 Frederick Soddy wprowadził pojęcie izotopów. Po doświadczalnym potwierdzeniu ich istnienia, zrozumiałe stały się ułamkowe masy atomowe pierwiastków - większość z nich jest mieszaniną kilku izotopów, a masa atomowa to średnia ważona mas wszystkich z nich.
W roku 1913 Henry Moseley badał promieniowanie X emitowane przez znane pierwiastki. Widmo rentgenowskie jest bardzo proste - każdy z pierwiastków emituje tylko dwie linie, których długości fal w prosty sposób wiążą się z ładunkiem jego jądra. Umożliwiło to po raz pierwszy określenie faktycznej liczby istniejących pierwiastków i potwierdziło celowość dokonanych przez Mendelejewa przestawień nieprawidłowych par. Niezmiernie ważnym było znalezienie luk w układzie okresowym, które czekały na wypełnienie. Samo prawo okresowości zostało nieco zmodyfikowane i od tamtej pory brzmi: właściwości fizyczne i chemiczne pierwiastków są periodyczną funkcją ich liczby atomowej.
W kolejnych latach odkrycie hafnu (1922) i renu (1925), a także identyfikacja sztucznie otrzymanych technetu (1937) i astatu (1940) to już tylko konsekwencje skorzystania z układu okresowego i wcześniejszego określenia właściwości poszukiwanych pierwiastków. Pełne wyjaśnienie prawa okresowości przyniosła dopiero mechanika kwantowa w latach 20. i 30. ubiegłego wieku. Okazało się, że okresowość właściwości pierwiastków jest odbiciem okresowości zapełniania ich powłok elektronowych.
Dzień dzisiejszy i przyszłość
W ciągu 150 lat opracowano ponad sto różnych form tablicy pierwiastków, ale uznanie zdobyły dwie z nich.
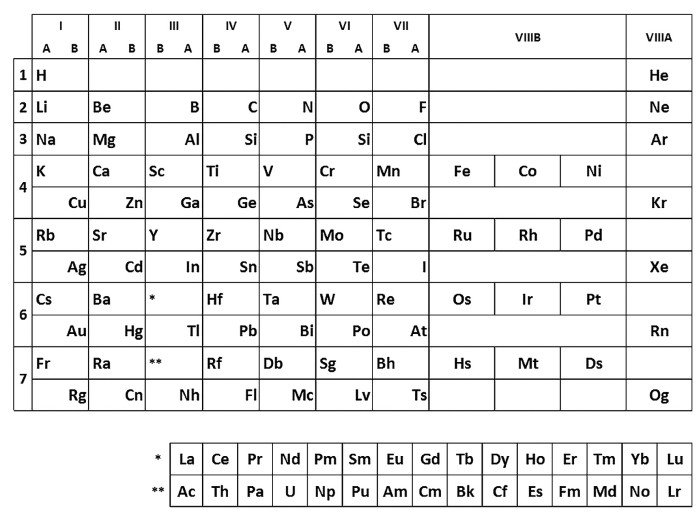
Pierwsza to postać krótka (pierwowzór podał sam Mendelejew). Dzieli się na okresy oraz grupy: główne (oznaczone: IA, IIA itd.) i poboczne (IB, IIB itd.). Lantanowce i aktynowce umieszcza się pod całym układem. Grupa VIIIB zawiera dziewięć pierwiastków podzielonych na triady - tu chemicy zasugerowali się podobieństwem występującym pomiędzy sąsiadującymi w okresie pierwiastkami. Lokalizacja wodoru jest umowna - jego własności odróżniają go od pierwiastków z każdej grupy. Krótka postać tablicy nie jest przejrzysta, ale jej grupy łączą ze sobą pierwiastki o tej samej wartościowości (5).
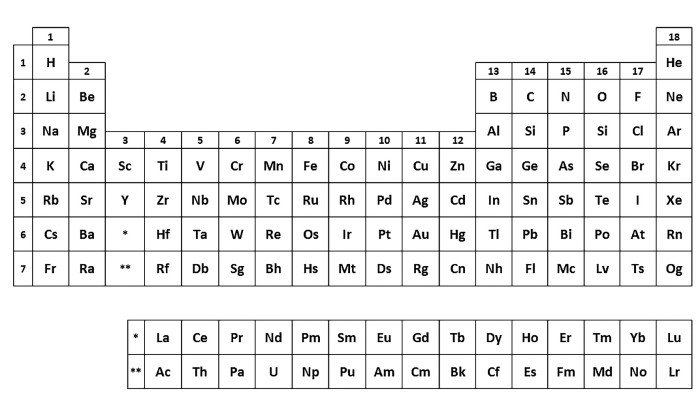
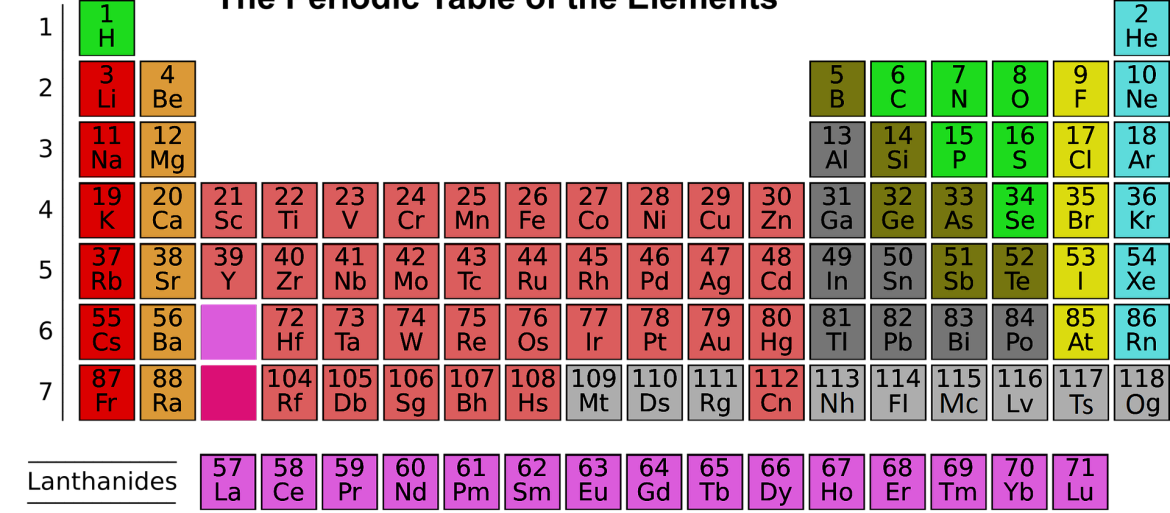
Obecnie najbardziej rozpowszechniona jest forma długa (pochodzi z początków XX wieku). Grupy główne oznaczone są w niej numerami 1 i 2 oraz od 13 do 18, a poboczne od 3 do 12 (lantanowce i aktynowce również umieszcza się pod tablicą). Zaletą jest przejrzystość oraz zgrupowanie pierwiastków w blokach energetycznych związanych z elektronami odpowiedzialnymi za wartościowość (6).
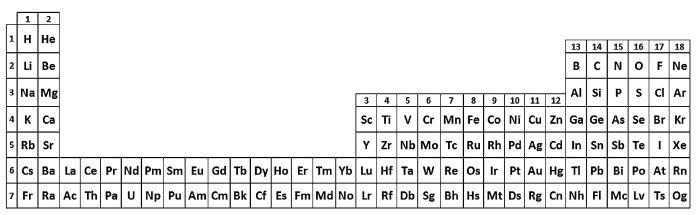
Pojawia się także jeszcze dłuższa forma tablicy - z lantanowcami i aktynowcami umieszczonymi pomiędzy grupami 2 i 3. Problemy z drukiem długich tablic pojawią się wtedy, gdy zostaną otrzymane pierwiastki z okresu 8. A to może nastąpić już niebawem, ponieważ fizykom udało się wypełnić cały okres 7 (patrz: "Sztuczne pierwiastki", MT 2018) (7).
W ciągu lat prawo okresowości wielokrotnie dowiodło swej przydatności i wyszło obronną ręką z wielu zagrożeń. Fakty, które wydawały się mu przeczyć, pozwoliły w konsekwencji na bardziej dogłębne jego zrozumienie. Graficzne przedstawienie prawa okresowości, czyli tablica układu okresowego pierwiastków, stało się zaś dla każdego symbolem chemii.
O Mendelejewie krążyło wiele anegdot, a jego wizerunek, z nieodłączną zmierzwioną brodą, był w XIX wieku tak znany, jak w ubiegłym stuleciu postać Alberta Einsteina z wiecznie rozczochraną czupryną. Pierwsze małżeństwo Mendelejewa rozpadło się. Według prawa obowiązującego w Rosji, nie mógł się on powtórnie ożenić przed upływem siedmiu lat od rozwodu. Udało mu się jednak znaleźć popa, który za wysokie honorarium zgodził się na udzielenie ślubu. Sprawa nabrała rozgłosu i duchownego pozbawiono uprawnień, ale Mendelejew pozostał bezkarny, choć prawnie był bigamistą. Gdy pewien arystokrata, powołując się na przypadek słynnego chemika, zwrócił się do samego cara o pozwolenie na zawarcie małżeństwa przed upływem siedmiu lat od rozwodu, władca odparł: "Mendelejew ma co prawda dwie żony, ale ja mam tylko jednego Mendelejewa".
Krzysztof Orliński