Sztuczne pierwiastki - część 1

Jednak decyzja IUPAC (International Union of Pure and Applied Chemistry) z 30 listopada 2016 r. nie oznacza wcale, że dysponujemy wszystkimi 118 pierwiastkami.
"Jak to? Przecież otrzymano je i nazwano! Dlaczego zatem nie mamy wszystkich pierwiastków? Tablica Mendelejewa kłamie?" - oburzy się niejeden z Czytelników.
Zanim jednak układ okresowy straci wiarygodność w Twoich oczach, zastanów się, co to znaczy:
…mieć pierwiastek?
Czas życia
Dla szacowania czasu życia pierwiastków promieniotwórczych fizycy posługują się pojęciem okresu połowicznego rozpadu. Jest to czas, po którym pozostaje połowa początkowej ilości pierwiastka. Jednak po upływie drugiego takiego samego czasu cały pierwiastek nie zniknie, lecz pozostanie go połowa połowy, czyli ćwierć początkowej ilości. I tak dalej. Teoretycznie nawet po upływie nieskończenie długiego czasu pozostanie pewna część początkowej ilości, ale w praktyce przyjmuje się, że po dziesięciu okresach praktycznie nie ma już substancji promieniotwórczej.
Przewody elektryczne, pierścionek i aluminiowa puszka niewątpliwie świadczą o istnieniu miedzi, złota czy glinu. W powietrzu, o czym wiesz ze szkoły, znajdują się azot i tlen. Reaktywne pierwiastki, jak sód i chlor, tworzą sól kuchenną. Także i te pierwiastki mamy, a wyobraźnia podpowiada, że gdzieś na półkach chemicznych laboratoriów znajdują się ich próbki. Jeśli pojęcie laboratorium rozszerzyć na miejsca przechowujące również silnie promieniotwórcze pierwiastki, to okaże się, że ostatnim z istniejących jest einstein, o liczbie porządkowej 99. Przy czym istnienie należy rozumieć potocznie, jako obecność pierwiastka lub jego związku w dostrzegalnych ilościach. Do tego zaś jest potrzebne dysponowanie co najmniej milionową częścią grama, inaczej bowiem nie powstanie nawet najdrobniejszy kryształek związku chemicznego (w przypadku pierwiastka 100 - fermu - informacje o otrzymaniu niezbędnej jego ilości nie zostały w pełni potwierdzone).
Z tym problemem musiała zmierzyć się Maria Skłodowska-Curie na początku ubiegłego stulecia. Promieniowanie radu i polonu nie wystarczało ówczesnym chemikom do uznania istnienia tych pierwiastków - dopiero wydzielenie ułamkowych części grama ich związków przekonało wątpiących. Nie krytykujmy jednak tradycjonalistów. Owo podejście jest jak najbardziej praktyczne: niewiele bowiem można zrobić w zwykłym laboratorium z tak małą ilością substancji, że nie sposób jej nawet dostrzec.
Powód "nieistnienia" to oczywiście czas życia niektórych pierwiastków - zbyt krótki, aby dotrwały do chwili obecnej od uformowania się Ziemi z kosmicznego pyłu. Podczas wybuchów supernowych tworzą się nawet najcięższe pierwiastki, które następnie rozsiewane są w promieniu wielu lat świetlnych od eksplodującej gwiazdy. W sprzyjających warunkach okruchy łączą się w większe skupiska, a te w planety. Jednak 4,5 mld lat to stanowczo za długo, aby pewne pierwiastki pozostały na naszym globie w uchwytnych ilościach (im cięższy, tym jest go z reguły mniej i krócej żyje). Dlatego, aby poddać je badaniom, należało brakujące elementy materii wytworzyć. Nie odkryć, bo nie istniały ukryte przed "uczonych szkiełkiem i okiem", lecz po prostu wyprodukować.
Naturalne czy sztuczne?
Ile mamy fransu i astatu?
Bardzo niewiele. Szacuje się, że w każdej chwili w skorupie ziemskiej znajduje się nie więcej niż 50 gramów fransu. Jeżeli zaś chodzi o astat, to jest go jeszcze mniej - ok. grama! W obu przypadkach powodem jest bardzo krótki czas życia naturalnych izotopów, a ponadto mało wydajny sposób powstawania - tworzą się w bocznych odgałęzieniach szeregów promieniotwórczych o niewielkim prawdopodobieństwie zajścia właściwej przemiany. Nic dziwnego, że do tej pory nikt nie wydzielił widocznej porcji tych pierwiastków i w najbliższej przyszłości na to się nie zanosi.Podział nie jest tak oczywisty, jak mogłoby się na pierwszy rzut oka wydawać. Z klasyfikacją dość dobrze nam idzie w przypadku wytworów własnych rąk, np. śrub czy nakrętek. Jeżeli jednak wkraczamy na teren działania przyrody, gdzie granice nie są ostre, pojawiają się problemy w postaci obiektów, które można przypisać do różnych grup.
Nie inaczej dzieje się i z pierwiastkami. Uran jest najcięższym elementem, którego czas życia pozwolił na przetrwanie do współczesności (okres połowicznego rozpadu jest porównywalny z wiekiem naszej planety, zatem uranu mamy jeszcze około połowy tej ilości, która weszła w skład młodej Ziemi). Masywniejsze od niego pierwiastki zostały wytworzone przez człowieka (o tym w dalszej części cyklu), ale kilka z nich odkryto później jako uboczne produkty przemian spowodowanych rozpadem jąder uranu.
Podobna sytuacja ma miejsce w przypadku nietrwałych pierwiastków o masie mniejszej niż uran. Kilka z nich ma bardzo krótki czas życia (dla fransu to tylko 20 minut, a dla astatu co najwyżej sekundy, choć sztucznie otrzymany izotop tego pierwiastka ma okres połowicznego rozpadu wynoszący osiem godzin), a ich istnienie w przyrodzie jest tylko konsekwencją nieustannego zasilania przez rozpadające się jądra uranu i toru (patrz: Szeregi promieniotwórcze). Dwa pierwiastki położone w środkowej części układu okresowego - technet i promet - mimo dziesięcioleci starań chemików nie zostały znalezione w przyrodzie. Dopiero po ich wyprodukowaniu okazało się, że stanowią produkt bardzo rzadkich, samorzutnych rozszczepień jąder uranu i zostały zidentyfikowane w skrajnie śladowych ilościach w rudach tego metalu.
Ponadto niektóre wytworzone przez człowieka pierwiastki są lepiej poznane niż trwałe, dawno już odkryte. W niektórych przypadkach produkcja sztucznych jest większa niż cały światowy zasób substancji prostych uznawanych za naturalne (patrz: Ile mamy fransu i astatu?)! Powód to oczywiście zastosowania: promieniotwórczego plutonu zużywa się rocznie ok. 20 ton, natomiast metalicznego strontu prawie nikt nie potrzebuje i jego produkcja sięga najwyżej kilogramów. Dodajmy jeszcze fakt skażenia powierzchni Ziemi produktami działania elektrowni atomowych i wybuchów jądrowych (głównie jądra lżejsze od uranu) oraz termojądrowych (w tym przypadku tworzą się również i cięższe od niego), a będziemy mieli pełen obraz trudności z dokonaniem prostego, zdawałoby się, podziału: pierwiastek naturalny czy sztuczny?
"Dziurawy" układ okresowy
Największym osiągnięciem chemii XIX wieku było skonstruowanie tablicy układu okresowego (w przyszłym roku dziełu Mendelejewa "stuknie" 150 lat!). Geniusz jej twórcy objawił się m.in. w fakcie pozostawienia wolnych miejsc dla jeszcze nieodkrytych pierwiastków i przewidzenia ich właściwości. W miarę wypełniania luk w tablicy (niektóre z przepowiedni się nie sprawdziły) pojawiło się pytanie: ile naprawdę istnieje pierwiastków?
Odpowiedzi udzielił młody, niespełna 26-letni, angielski fizyk Henry Moseley, w roku 1913. Odbywając staż w laboratorium odkrywcy jądra atomowego, Ernesta Rutherforda, badał promieniowanie rentgenowskie emitowane przez wzbudzone atomy. Udało mu się powiązać długości fal wysyłanych promieni X z ładunkiem jąder atomowych, ten zaś był inny dla każdego z pierwiastków, stanowiąc jednoznacznie określającą go cechę. Jednak wkrótce wybuchła Wielka Wojna, Moseley został zmobilizowany i dwa lata później poległ pod Gallipoli. Badania wykazały, że najcięższy ze znanych - uran - ma 92 protony w jądrze, zatem i tyle istnieje pierwiastków (przynajmniej w owym czasie). Znaczyło to również, że w układzie okresowym brakuje siedmiu pierwiastków zajmujących 43, 61, 72, 75, 85, 87 i 91 miejsce. Chemicy i fizycy ruszyli na naukowe łowy, tym łatwiejsze, że wiedziano już, gdzie i czego szukać - położenie nieznanych pierwiastków w tablicy Mendelejewa umożliwiło określenie ich własności i przypuszczalnych miejsc występowania.
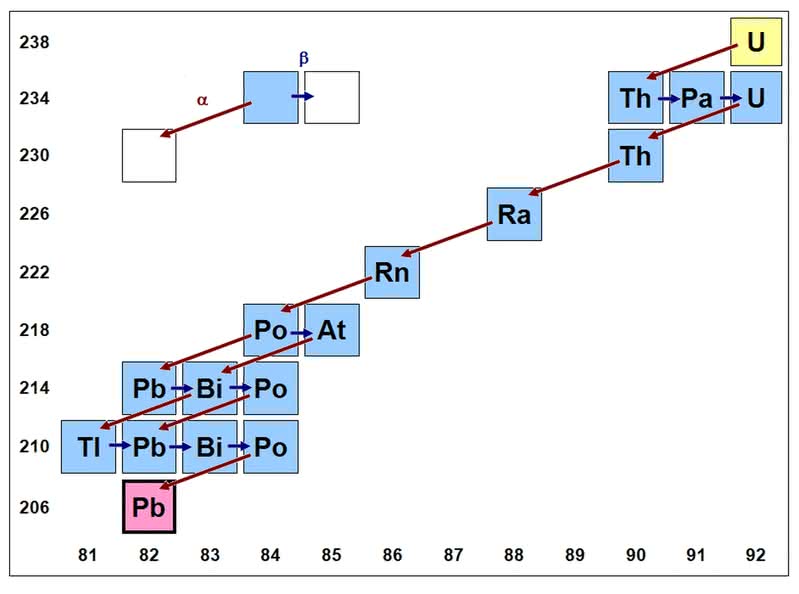
Szeregi promieniotwórcze - dwa izotopy uranu oraz jeden toru o długim czasie życia rozpadają się z utworzeniem również promieniotwórczych jąder. Te z kolei ulegają dalszemu rozpadowi itd. Po kilkunastu przemianach powstają wreszcie trwałe izotopy ołowiu. Ciąg izotopów, z których jeden powstaje z drugiego, to właśnie szereg promieniotwórczy. Po otrzymaniu neptunu okazało się, że jeden z jego izotopów również zapoczątkowuje szereg. Jednak stosunkowo krótki czas życia jego członków spowodował, że szereg wygasł w naturze, a jedyną pozostałością po nim jest obecność ostatniego w ciągu - bizmutu.
W roku 1923 odkryto hafn (nr 72), a dwa lata później - ren (nr 75). Odkrywcy tego ostatniego borykali się z podobnym problemem, co nasza rodaczka kilkanaście lat wcześniej. I oni także musieli przerobić duże ilości rudy, aby otrzymać widoczne próbki związków nowego pierwiastka. Do identyfikacji posłużyli się metodą Moseleya. W widmie dostrzegli również częstotliwości wskazujące na jeszcze jeden pierwiastek z tej samej grupy o numerze 43, ale nie potwierdzono ich obserwacji. Technet, bo o nim mowa, jako pierwszy z pierwiastków otrzymano sztucznie (łac. technetos = sztuczny), w roku 1937, w wyniku bombardowania molibdenu (nr 42) jądrami izotopu wodoru (nr 1). Pierwiastek ten jest promieniotwórczy, choć długi czas życia umożliwia jego zastosowanie. Później okazało się, że i technet występuje w przyrodzie jako efekt samorzutnych rozpadów jąder uranu.
W toku badań naturalnych szeregów promieniotwórczych odkryto protaktyn (nr 91) i frans (nr 87). Natomiast pierwiastek 85 został najpierw otrzymany sztucznie, przez bombardowanie tarczy z bizmutu (nr 83) cząstkami alfa (jądra helu zawierające dwa protony i dwa neutrony). Z powodu bardzo krótkiego czasu połowicznego zaniku nowy pierwiastek nazwano astatem (gr. astatos = nietrwały). Poznanie jego właściwości chemicznych pozwoliło kilka lat później wykryć astat w rudach uranu i toru, gdzie występuje jako jeden z produktów ich rozpadu.
Ostatni z brakujących - promet, z 61 protonami w jądrze - zidentyfikowano w roku 1945, badając pozostałości zużytego paliwa uranowego w reaktorze. Nazwa pierwiastka pochodzi od mitycznego Prometeusza, który - jak niegdyś olimpijski ogień - przyniósł ludzkości nowe źródło energii. Również i ten pierwiastek w śladowych ilościach występuje w rudach uranu.