Błędne ścieżki prowadzą do celu - część 2

Sukcesy...
Teoria flogistonowa powstała na bazie obserwacji spalania drewna, węgla drzewnego i kamiennego. Pozostały popiół waży mniej niż użyte paliwo, wywnioskowano więc, że z substancji ulatuje hipotetyczny fluid ognia, czyli flogiston (produktów gazowych nie brano pod uwagę). Teoria, rozszerzona także na substancje nieorganiczne, a zwłaszcza metale, była pierwszym w historii chemii nowoczesnym wytłumaczeniem szerokiego zakresu obserwowanych przemian. Dokonano także wyraźnego rozróżnienia pomiędzy chemią nieorganiczną i organiczną. W tej pierwszej można było poddać substancję szeregowi reakcji i odzyskać ją w wyjściowej postaci w takiej samej ilości, np. spalić metal, działaniem kwasu zmienić powstałą ziemię (tlenek) w sól, z soli wytrącić wodorotlenek, przez prażenie wodorotlenku uzyskać tlenek, który pod wpływem ogrzewania z węglem znowu przekształcał się w metal. Z substancjami organicznymi taki ciąg przemian był niewykonalny, zresztą dobrze wiesz, że np. zwęglonego ziemniaka nie da się przywrócić do stanu początkowego. Za przekształcenia substancji organicznych miała odpowiadać tajemnicza vis vitalis, czyli „siła życiowa” obecna tylko w świecie przyrody ożywionej (jej kariera potrwała do roku 1828).
Na podstawie teorii flogistonowej opracowano technologię dwóch ważnych procesów. Pierwszym z nich była synteza kwasu siarkowego, do dziś zaliczanego do najważniejszych produktów chemii. Do tej pory otrzymywano jego niewielkie ilości w wyniku prażenia naturalnie występujących siarczanów. Gdy kwas siarkowy stał się szeroko dostępny, można było za jego pomocą produkować inne ważne odczynniki (np. kwas azotowy i solny), wiele użytecznych substancji oraz oczyszczać metale. Kwas siarkowy wykorzystano także do drugiego ze wspomnianych procesów – produkcji sody, czyli węglanu sodu. Tę bardzo ważną substancję (surowiec do produkcji szkła i mydła) uzyskiwano z nielicznych złóż naturalnych oraz ze spalania wodorostów. Do metody opracowanej przez Nicolasa Leblanca potrzebne były sól kamienna i kwas siarkowy, a w rezultacie połączenia w jednej wytwórni obu procesów powstawały pierwsze kombinaty chemiczne (1). Współcześnie stosuje się już inne technologie, ale nadal wielkość produkcji kwasu siarkowego („krwi przemysłu chemicznego”) świadczy o zaawansowaniu rozwoju przemysłowego kraju, a sody używanej do wytwarzania mydła – o jego poziomie cywilizacyjnym.
z książki Hermanna Osta „Lehrbuch der Technischen Chemie”, 1890)
…i problemy
Z alchemii wyodrębniła się farmacja, której adepci zajmowali się wytwarzaniem medykamentów, do czego niezbędna była waga. Powszechne zastosowanie tego przyrządu postawiło przed teorią flogistonową problem nie do rozwiązania. O ile popiół rzeczywiście ważył mniej niż wzięte do spalenia drewno, o tyle ziemie metali były cięższe niż metale, z których powstały. Jak zatem mogło dojść do utraty flogistonu, skoro zwiększyła się masa substancji?
Teorii nie odrzuca się od razu, ale modyfikuje jej założenia, tak też postąpiono z flogistonem. Ponadto nie we wszystkich przypadkach obserwowano wzrost masy utlenianych metali, fakt ten spowodowany był jednak użyciem do ich podgrzewania soczewek skupiających promienie słoneczne. Sposób ten pozwalał uzyskiwać tak wysokie temperatury, że część powstających tlenków odparowywała i rzeczywiście stwierdzano ubytek masy. W XVIII wieku, po przełomowych pracach Newtona, nikt nie wierzył w ujemną masę flogistonu, ale zakładano, że jest on bardzo lekki, wszak ulatywał ze spalanej substancji. Ponieważ miał wypełniać wolne przestrzenie w każdym ciele palnym, zatem, na mocy prawa wyporu Archimedesa, po spaleniu ciało było cięższe niż przed tym procesem. Oczywiście następowało tu pomieszanie pojęć masy i ciężaru (a także gęstości), które – choć w po-tocznym języku stosowane wymiennie – nie są tym samym. Dlaczego zatem spalane substancje organiczne zachowywały się inaczej i faktycznie ich ubywało? Teoria nie potrafiła udzielić racjonalnej odpowiedzi i coraz więcej chemików podchodziło do niej nieufnie.
Jak schwytać ducha?
Do początków wieku XVIII chemia była „dwuwymiarowa”, czyli w bilansie masy uwzględniała tylko ciała stałe i ciecze. Oczywiście gazy znano od dawna, wielokrotnie stwierdzano wydzielanie „ducha” lub „powietrza” podczas przemian, ale nie zwracano uwagi na te ulotne produkty. Chemia gazów miała dopiero nadejść, a jej początkiem stało się wynalezienie wanny pneumatycznej przez angielskiego botanika Stephena Halesa (uprzednio zbierano gazy do zwierzęcych pęcherzy lub worków skórzanych – w domu możesz użyć baloników – ale nie były to wygodne sposoby). Przykładem takiego urządzenia jest probówka wypełniona wodą, odwrócona i zanurzona w płaskim krystalizatorze również wypełnionym wodą, do środka probówki wprowadzony jest wężyk z kolby, w której wydziela się gaz. Zestaw ten jest używany w szkole, a i w domowym laboratorium okazuje się przydatny (2).
Kilka praktycznych uwag dotyczących używania wanny pneumatycznej. Probówkę napełnij wodą, zakryj palcem i odwróconą umieść w większym naczyniu z wodą. Możesz również na wierzch wypełnionej „z czubkiem” probówki położyć kawałek bibuły i odwrócić ją – woda się nie wyleje (dla pewności całą operację wykonaj w zlewie). Do probówki wkładasz wężyk i czekasz, aż wydzielający się gaz wypchnie z niej wodę, potem probówkę zakorkuj pod wodą i przenieś w inne miejsce. Wężyk koniecznie wyjmij z wody, zanim zakończysz ogrzewanie naczynia reakcyjnego, inaczej podciśnienie wciągnie wodę do środka i może ono pęknąć.
W opisany sposób zbierasz gazy słabo rozpuszczalne w wodzie, np. wodór czy tlen. Te, które rozpuszczają się lepiej, zbierasz nad gorącą wodą (rozpuszczalność gazów maleje ze wzrostem temperatury) lub wręcz do naczynia umieszczonego w powietrzu (np. amoniak).
Powietrze to nie pierwiastek
Alchemicy wielokrotnie stwierdzali wydzielanie się gazów, zwykle jednak nie interesowali się tymi „duchami”. W połowie XVII wieku flamandzki lekarz i alchemik Johann van Helmont opisał szczegółowo jeden z nich, który powstawał w wyniku spalania drewna i oddychania. Nadał mu nazwę gazu leśnego (łac. gas silvestris, Helmont jest również autorem pojęcia „gaz”), jak się domyślasz, był to dwutlenek węgla. Po 100 latach szkocki chemik Joseph Black ponownie odkrył CO2 podczas badań nad substancjami alkalicznymi. Gaz ten wydzielał się podczas działania kwasów na węglany, skały wapienne, muszle i skorupki jaj. Black opracował też znaną do dziś procedurę wiązania dwutlenku węgla za pomocą wody wapiennej (roztwór wodorotlenku wapnia pochłania CO2 z wydzieleniem słabo rozpuszczalnego węglanu wapnia, co powoduje zmętnienie roztworu), skąd można go odzyskać działaniem kwasów. Z powodu łatwego wiązania gaz ten nazwano związanym powietrzem (ang. fixed air), a chemicy zaczęli uważać, że i podczas spalania metali również wiązany jest jakiś rodzaj powietrza (3).
odkrywca dwutlenku węgla i magnezu. Z prawej: pod wpływem kwasu ze skorupek jaj
wydziela się „związane powietrze” (dwutlenek węgla) – to charakterystyczna reakcja,
jakiej ulegają węglany
Roztwarzanie metali w kwasach z wydzieleniem wodoru to także reakcja znana już alchemikom. Angielski arystokrata, a przy tym chemik i fizyk (jako pierwszy wyznaczył wartość stałej grawitacji), Henry Cavendish określił ten gaz jako odrębną substancję w roku 1766. Miał to być ni mniej, ni więcej tylko sam …flogiston! Cavendish rozumował następująco: metale tracą flogiston w wyniku spalania, ale także roztwarzając się w kwasach (sole są niepalne), zatem to, co ulatuje po wrzuceniu np. żelaza do kwasu siarkowego, musi być flogistonem. Dodatkowo wodór spalał się wybuchowo (nazwano go powietrzem palnym, ang. inflammable air), co potwierdzałoby, że faktycznie był to od dawna poszukiwany fluid ognia (4).
Daniel Rutherford, uczeń Josepha Blacka, chciał się dowiedzieć, ile flogistonu może zostać pochłonięte przez powietrze atmosferyczne. W tym celu spalał w nim węgiel, a powstający gaz był absorbowany w roztworze zasadowym. Gdy w próbce powietrza już nic nie chciało się palić, Rutherford zbadał pozostałość po reakcji. Okazało się, że gaz ten ma mniejszą gęstość od zwykłego powietrza atmosferycznego i nie podtrzymuje palenia ani nie nadaje się do oddychania. W ten sposób w roku 1772 pojawiło się powietrze flogistonowane (czyli nasycone flogistonem), jak nazwał je flogistyk Rutherford, obecnie znamy je jako azot (5).
Istnienia w powietrzu czynnika odpowiedzialnego za spalanie i oddychanie domyślano się już w XVII wieku, ale oficjalnie pojawił się on w świecie nauki w roku 1774. Wtedy to angielski chemik i duchowny Joseph Priestley dokładnie zbadał powietrze, które wydzielało się z ogrzewanego tlenku rtęci. Gaz ten znakomicie podtrzymywał palenie oraz ułatwiał oddychanie, zatem – zgodnie z poglądami flogistyków, do których należał i Priestley – był on całkowicie pozbawiony flogistonu, skoro tak chętnie go pochłaniał. Nie powinna być zatem zaskoczeniem nadana mu nazwa – powietrze deflogistonowane. Dwa lata wcześniej tego samego odkrycia dokonał Carl Wilhelm Scheele, skromny szwedzki aptekarz, a przy tym doskonały chemik (zidentyfikował aż 6 nowych pierwiastków), który jednak spóźnił się z publikacją swojej pracy. Scheele także był flogistykiem i tlen (bo o tym gazie mowa) dla niego również stanowił powietrze pozbawione flogistonu. W każdym razie powietrze atmosferyczne okazało się mieszaniną co najmniej dwóch składników, z których jeden był całkowicie nasycony flogistonem (azot), a drugi zupełnie go pozbawiony (tlen). Nastąpił koniec arystotelesowskiego żywiołu (6).
oraz ówczesna aparatura stosowana do doświadczeń z gazami (ilustracja
z książki J. Priestleya „Experiments and Observations on Different Kinds of Air”, 1775)
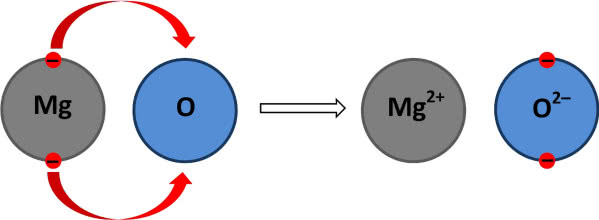
Spalanie (gwałtowne łączenie z tlenem z towarzyszącymi efektami cieplnymi i świetlnymi) to szczególny rodzaj szerszego zjawiska, czyli utleniania. Dodatkowo zjawisko to rozumiane jest nie tylko jako reakcja z tlenem, ale zwiększenie stopnia utlenienia polegające na utracie elektronów (pamiętaj, że elektrony mają ładunek ujemny). Oczywiście elektrony nie znikają, lecz są przyłączane przez substancję utleniającą, np. tlen (on z kolei ulega redukcji, czyli zmniejszeniu stopnia utlenienia). Jeżeli tak interpretować spalanie, elektrony stanowią swoisty „flogiston” (7).
Krzysztof Orliński