Błędne ścieżki prowadzą do celu - część 3

Flogiston? Nie, tlen!
Poprzedni odcinek zakończył się informacją o spotkaniu odkrywcy tlenu Josepha Priestleya z Antoin'em Lavoisierem (1). Francuski uczony z wykształcenia był prawnikiem, lecz zajmował się naukami przyrodniczymi. Początkowo i on, jak wszyscy chemicy, uznawał teorię flogistonu, ale – zachęcony informacjami o „powietrzu deflogistonowanym” Priestleya – przystąpił do własnych badań nad procesem spalania.
Lavoisier był zamożny, większość prac finansował z własnych środków (podobnie jak lord Cavendish, angielski arystokrata i odkrywca wodoru) i mógł sobie pozwolić na najlepszą ówcześnie aparaturę (2). O jego poświęceniu dla nauki świadczy następujący fakt. Lavoisier z racji członkostwa we Francuskiej Akademii Nauk badał m.in. jakość wody dostarczanej do Paryża. W tym celu przez kilka miesięcy bez przerwy (!) destylował wodę – para po skropleniu wracała do ogrzewanego naczynia. Po zakończeniu doświadczenia masa wody wzrosła ze względu na wyługowanie składników szkła, ale o taką samą ilość zmniejszyła się masa aparatu destylacyjnego. Eksperyment dowiódł (wbrew poglądom Arystotelesa), że woda nie może przekształcać się w „ziemię”.
wraz ze współpracownikami, z prawej widoczna żona uczonego Marie-Anne,
która pomagała mu w pracy (ilustracja z XVIII wieku)
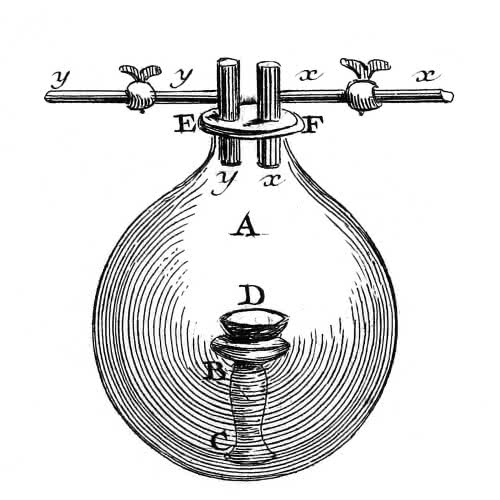
Podczas doświadczeń ze spalaniem Lavoisier równie drobiazgowo podchodził do pracy. Dla przykładu: spalał fosfor w zamkniętym naczyniu, a po zakończeniu eksperymentu porównał masy układu przed i po reakcji (3). Ponieważ były one dokładnie identyczne, dowiódł tym samym prawa zachowania masy, co w chemii sprowadza się do stwierdzenia, że w każdej reakcji chemicznej masa produktów jest równa masie substratów. Lavoisier stwierdził również spadek ciśnienia powietrza wypełniającego naczynie, co było wynikiem pochłonięcia jednego ze składników atmosfery – w wyniku badań okazało się, że fosfor wiąże się z tlenem. Spalanie nie było zatem, jak twierdzili flogistycy, reakcją analizy (rozkładu)
fosfor ≠ ziemia (tlenek) fosforu + flogiston
lecz syntezy (łączenia)
fosfor + tlen = tlenek fosforu
został podpalony za pomocą światła słonecznego skupionego soczewką (szkic z roku 1789)
Kolejnym ciosem dla teorii flogistonu była reakcja rozkładu tlenku rtęci. O ile w innych przypadkach, aby z tlenku metalu otrzymać metal, należało prażyć ten związek z węglem, o tyle samo ogrzewanie wystarczało, aby z tlenku rtęci powstała metaliczna rtęć. Flogistycy umieli wytłumaczyć przebieg pierwszej reakcji (ziemia + flogiston z węgla = me-tal), ale mechanizm drugiej był tajemnicą – skąd wziął się flogiston niezbędny do redukcji tlenku? Lavoisier, na podstawie wcześniejszych doświadczeń ze spalaniem, rozumował następująco: tlenek me-talu + węgiel = metal + dwutlenek węgla, natomiast w drugim przypadku po prostu tlenek rtęci = rtęć + tlen. Eksperymenty potwierdziły taki właśnie przebieg obu procesów.
Jednak pozostawało wyjaśnienie przebiegu reakcji z kwasami:
metal + roztwór kwasu = roztwór soli + wodór
tlenek metalu + roztwór kwasu = roztwór soli
Flogistycy mogli je wytłumaczyć: metal zawierający flogiston traci go w reakcji z kwasem (Cavendish twierdził nawet, że wodór jest flogistonem), natomiast ziemia (tlenek) metalu jest go pozbawiona i dlatego flogiston nie wydziela się w tej reakcji. Lavoisier nie umiał wyjaśnić różnicy w przebiegu obu procesów, ponieważ nie znał odpowiedzi na pytanie…
…czym jest woda?
Wkrótce po odkryciu wodoru zauważono, że z powietrzem i tlenem gaz ten tworzy mieszaninę wybuchową. Efekt wykorzystano w pokazach, m.in. eksplozjami wyjaśniano wyładowania atmosferyczne, wybuch był zaś najsilniejszy, gdy wodór z tlenem reagował w proporcji objętościowej 2:1. W czasie pokazu przeprowadzanego przez Priestleya, jego gość, James Watt, wynalazca maszyny parowej, zwrócił uwagę na rosę, która pojawiła się po eksplozji. Priestley nie potrafił wytłumaczyć tej obserwacji, ale wraz z innymi chemikami zabrał się do jej zbadania. Okazało się, że w wyniku reakcji „powietrza palnego” (wodoru, utożsamianego z samym flogistonem) z „powietrzem deflogistonowanym” (tlenem) powstaje woda, nie zaś – jak wynikałoby z teorii flogistonu – zwykłe powietrze. Kolejna zagadka.
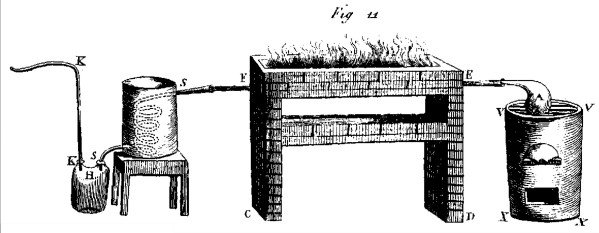
Na wieść o odkryciu Brytyjczyków, w Paryżu również rozpoczęto badania. Gdy Lavoisier przepuszczał parę wodną przez rozgrzaną do czerwoności rurę, zawierającą opiłki żelaza, we wnętrzu rury powstawał tlenek żelaza, a u wylotu można było zbierać gazowy wodór (4). Gdy zaś przez tę samą rurę przepuszczono wodór, tlenek żelaza przekształcał się w metaliczne żelazo, a z końca uchodziła para wodna. Dokonano także rozkładu wody na składniki za pomocą iskier z maszyny elektrostatycznej, wyładowania inicjowały również wybuch w mieszaninie obu gazów. Stało się zatem jasne, że woda to związek wodoru z tlenem. Lavoisier mógł już wy-jaśnić przebieg reakcji tlenków metali z roztworem kwasu – jednym z produktów była po prostu woda (tlen pochodził z tlenku metalu, a wodór z kwasu), która jednak pozostawała niezauważona w również wodnym środowisku reakcji. Tak zakończyły się dzieje ostatniego pierwiastka Arystotelesa.
przechodzi przez ogrzewaną w ogniu rurę E zawierająca
opiłki żelaza i skrapla się w pojemniku H,
powstający wodór uchodzi przez rurkę K (szkic z roku 1789)
Podstawowy traktat chemii
W roku 1787 Lavoisier przedstawił zasady nowego nazewnictwa chemicznego opartego na dwóch regułach: każda substancja ma tylko jedną nazwę i nazwa ta wynika z jej składu chemicznego. W ogólnych zarysach zasady te obowiązują do dzisiaj. Wcześniej używano nazw zwyczajowych (zresztą obecnie również się je stosuje, aby uniknąć skomplikowanych nazw oficjalnych, zwłaszcza w chemii organicznej) i współczesny chemik miałby trudności z identyfikacją związków, natomiast prace napisane zreformowanym językiem są zrozumiałe, np. dawne witriole to obecne siarczany (od razu wiemy, że są to sole kwasu siarkowego). Od wprowadzenia nowego nazewnictwa datuje się początek odkryć i teorii (nie brakło wśród nich tytułowych błędnych ścieżek, ale to już zupełnie inna historia), które doprowadziły do obecnej postaci chemii.
Lavoisier we wstępie do swojej najbardziej znanej pracy Traité Élémentaire de Chimie (1789) napisał wprost, że miał zamiar zmienić stare nazewnictwo, ale w tym celu musiał zreformować całą chemię (5). W Traktacie podał przede wszystkim definicję pierwiastka chemicznego jako kresu chemicznej analizy. Mimo wyjaśnienia budowy atomów i ich jąder, w praktyce nadal obowiązuje ona w postaci umowy, że pierwiastek to substancja, której nie można rozłożyć na składniki metodami stosowanymi w chemii.
Zamieszczona w książce lista obejmowała 33 „pierwiastki”. Cudzysłów nie jest przypadkowy, figurowały na niej m.in. cieplik i świetlik (fluidy ciepła i światła), którymi tłumaczono efekty cieplne i świetlne towarzyszące reakcjom chemicznym (6). W następnym wieku przekształciły się one w pojęcia energii oraz fal świetlnych. Szczególna rola przypadła trzem pierwiastkom, traktowanym jako tzw. zasady (nadal brzmiały echa średniowiecznych teorii). Był to wodór – zasada tworząca wodę, tlen – zasada tworząca kwasy i azot jako zasada tworząca alkalia. Stąd ich międzynarodowe nazwy: Hydrogenium („tworzący wodę”, gr. hydro = woda, gennao = t worzę), Oxygenium (gr. oxys = kwas) i Nitrogenium (gr. nitron = s aletra). W ostatnim przypadku Lavoisier, choć nawet po francusku gaz ten nosi nazwę azote, skorzystał z doświadczeń lorda Cavendisha, który odkrył, że w wyniku wyładowań elektrycznych w powietrzu powstają tlenki azotu, dające z wodą kwas azotowy – ten sam, z którego powstaje saletra. Jeżeli zaś chodzi o „zasadę alkaliczności”, azot jest zawarty w amoniaku, czyli dawnej „zasadzie lotnej” alchemików, a sam Lavoisier przypuszczał, że azot wchodzi również w skład innych związków o odczynie zasadowym. W wielu językach stosuje się dosłowne tłumaczenia nazw tych pierwiastków,
np. Jędrzej Śniadecki, „ojciec polskiej chemii”, pisał o nich: wodoród, kwasoród i saletroród.
na ilustracji z podręcznika nomenklatury chemicznej („Méthode de Nomenclatura Chimique”, 1787)
Na liście znalazło się 17 znanych wtedy metali, kilka niemetali oraz ziemie, których nie umiano jeszcze rozłożyć na składniki (wapno CaO, magnezja MgO, baryta BaO i krzemionka SiO2). Sam Lavoisier przypuszczał, że są one substancjami złożonymi, podobnie jak soda (węglan sodu) czy też potaż (węglan potasu).
Ważną częścią Traktatu był opis doświadczeń potwierdzających, że spalanie polega na reakcji z tlenem oraz eksperymentów dowodzących, że woda to związek wodoru z tlenem. Temu ostatniemu pierwiastkowi przypadła szczególna rola w nowej chemii. Nie tylko stanowił on spoiwo łączące różne pierwiastki ze sobą (np. w solach), ale przede wszystkim nadawał kwasowe właściwości tlenkom niemetali, np. dwutlenkowi węgla, tlenkom siarki, azotu czy też fosforu. Według Lavoisiera każdy kwas zawierał tlen. Każdy, w tym i kwas solny, ówcześnie zwany muriatycznym (łac. murex = solanka, kwas otrzymywano z soli kamiennej), a zawartemu w nim pierwiastkowi, którego tlenek miał tworzyć ten kwas, nadano nazwę Murium.
Traktat kończył się opisem aparatury chemicznej i czynności laboratoryjnych (część ta przez wiele lat stanowiła podręcznik dla pracowni chemicznych) (7). Książka została szybko przetłumaczona na wiele języków i wywarła decydujący wpływ na obalenie teorii flogistonu, przyjęcie tlenowej teorii spalania oraz nazewnictwa chemicznego opartego na składzie substancji.
Rewolucja chemiczna
Antoine Lavoisier, uznawany za ojca nowoczesnej chemii, nie był jej jedynym twórcą – korzystał z osiągnięć poprzedników, a po nim również inni chemicy przyczynili się do zmiany obrazu tej nauki. Niżej kilka ważniejszych dat (8).
U góry od lewej: Joseph Proust i John Dalton,
u dołu od lewej Humphry Davy i Jöns Jakob Berzelius
1799. Joseph Louis Proust podaje prawo stałości składu: związek chemiczny ma stały, ściśle określony skład, niezależnie od pochodzenia i sposobu otrzymania. Od tego czasu zaczęto rozróżniać związki chemiczne od mieszanin (roztworów, stopów).
1804. John Dalton ogłasza atomistyczno-cząsteczkową teorię budowy materii.
1807–10. Humphry Davy o trzymuje kilka metali z ziem Lavoisiera oraz udowadnia, że chlor to pierwiastek, nie zaś tlenek hipotetycznego Murium – w ten sposób chemia poznaje kwasy beztlenowe.
1814. Jöns Jakob Berzelius wprowadza stosowaną do dziś symbolikę pierwiastków – uniwersalny język chemii.
W historii nauki lata 1770–1815 określa się mianem rewolucji chemicznej, czasem dodając „pierwszej”, co oznacza, że nie był to jedyny przełom w jej dziejach (kolejny nastąpi wraz z publikacją tablicy układu okresowego w roku 1869). Patrząc zaś na współczesne osiągnięcia nauki, można stwierdzić, że rewolucja w chemii trwa nadal.
Krzysztof Orliński