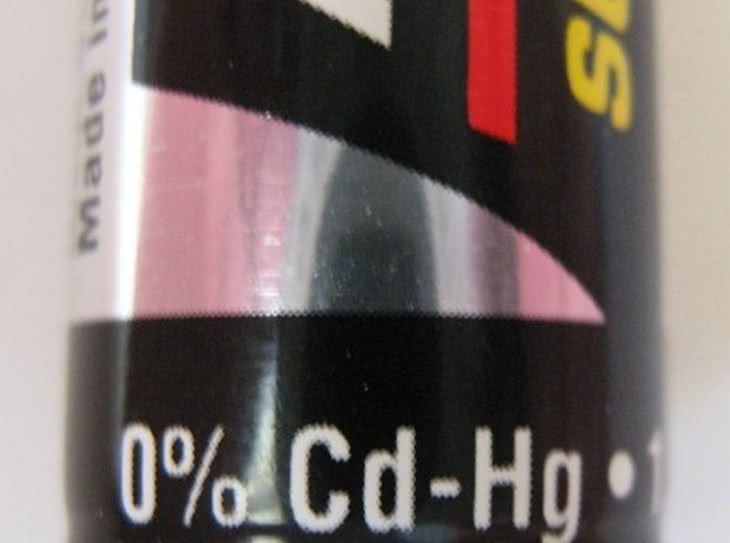Ogniwa używane współcześnie

Podczas poprzednich spotkań omówiliśmy pierwsze nowożytne typy ogniw galwanicznych, które znalazły praktyczne zastosowania ? stos Volty i ogniwo Daniella. Pora zatem na poznanie ogniw stosowanych współcześnie, chociaż ich historia liczy wiele już lat. Oczywiście (jak w przypadku innych wynalazków), obecnie produkowane modele znacznie różnią się od swoich pierwowzorów. Zasada działania jednak wciąż pozostaje taka sama.
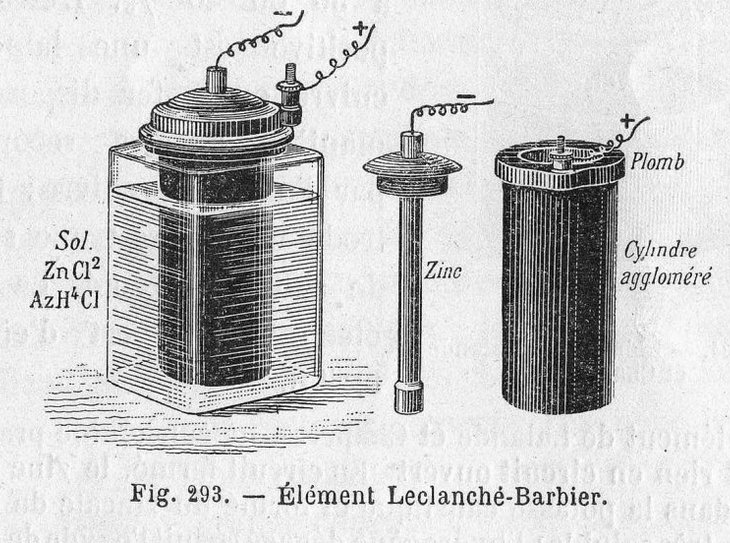
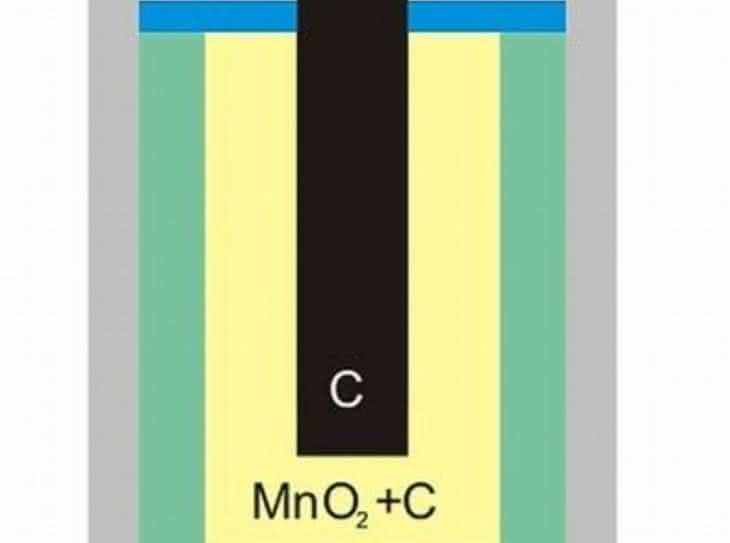
Ogniwo Leclanchégo W roku 1866 francuski inżynier Georges Leclanché (1839?1882) zbudował ogniwo, które do dziś stosujemy do zasilania drobnego sprzętu, np. przenośnych radioodbiorników, pilotów telewizyjnych, latarek, aparatów fotograficznych. Nie pomylmy jednak owych ?baterii? (jak się je popularnie, choć błędnie, nazywa) z powszechnie używanymi akumulatorkami o takich samych rozmiarach (całkowicie pewnym kryterium rozróżnienia jest cena?). Oryginalna konstrukcja Leclanchégo miała jednak wadę ogniw Volty i Daniella ? używano w niej ciekłego elektrolitu. Ogniwo składało się z naczynia, do którego wstawiano elektrodę cynkową oraz pojemnik z porowatego materiału (np. niepolewanej porcelany). Do pojemnika wsypywano wilgotny proszek dwutlenku manganu MnO2 (braunsztyn) zmieszany z pyłem grafitowym i umieszczano w nim grafitowy pręt. Zewnętrzne naczynie wypełniano stężonym wodnym roztworem chlorku amonu NH4Cl. Na elektrodach ogniwa zachodzą następujące reakcje:
(-)Zn0 ? ZN2+ + 2e-
(+) 2NH4+ + 2e- ? 2NH3+ H2
Ale to nie wszystko. Wolny amoniak wiązany jest przez jony cynkowe w kompleksowy kation tetraaminacynku, a wodór reaguje z braunsztynem, tworząc tlenowodorotlenek manganu(III):
Zn2+ + 4NH3 ? [Zn(NH3)]2+
2MnO2 + H2 ? 2MnO(OH)
Dwutlenek manganu pełni rolę tzw. depolaryzatora elektrody grafitowej, pochłaniając wydzielany wodór (inaczej gromadzący się na powierzchni węglowej pałeczki gaz izolowałby ją od reszty elektrolitu i przerywał przepływ prądu). Ogniwa Leclanchégo o napięciu pracy ok. 1,5 V stosowano do zasilania telegrafów, dzwonków elektrycznych, a nawet pierwszych aparatów telefonicznych. Wygodę użytkowania zwiększyło zbudowanie suchej wersji ogniwa. Dokonał tego w 1887 roku niemiecki wynalazca Carl Gassner (1855?1942), zastępując ciekły roztwór chlorku amonu mieszaniną tej soli z wilgotnym pyłem gipsowym (obecnie stosuje się zwykle kleik skrobiowy lub żel krzemionkowy). Wreszcie przestało grozić rozlanie cieczy! Ogniwo nie jest jednak całkowicie pozbawione wody ? gdyby tak było, nie mogłoby przecież funkcjonować. Zarówno dla mokrej, jak i suchej wersji schemat budowy jest następujący:
(-)Zn l NH4Claq l MnO2,C(+)
Chemiczna sekcja
Przeprowadzimy sekcję ogniwa Leclanchégo i potwierdzimy obecność niektórych substancji (a przy okazji poznamy szczegóły konstrukcji). Spojrzymy również na zużyte baterie jako na źródło potencjalnych surowców dla naszego laboratorium ? przeprowadzimy domowy recykling. Sprawdźmy jeszcze, czy rzeczywiście dysponujemy klasycznym ogniwem cynkowo-grafitowym (nosi ono oznaczenie typu: R03, R6, R14, R20, 3R12) i do pracy! Najpierw przygotujmy stanowisko. Przyda się taca (aby nie pobrudzić wszystkiego wokół) i ochronne rękawice (w celu uniknięcia skaleczenia). Do rozebrania ogniwa potrzebne będę obcęgi lub nożyce do metalu. Po zdjęciu ochronnej powłoki (zwykle wykonanej z metalu) z nadrukowanymi informacjami widzimy już cynkowy kubeczek. Za pomocą kleszczy ostrożnie wyciągamy grafitowy pręcik, który jest niezwykle przydatny do przeprowadzania wielu eksperymentów z elektrochemii. Oczyśćmy go więc starannie i odłóżmy na później (nie usuwajmy mosiężnej ?czapeczki? z wierzchołka elektrody, łatwo przylutować do niej przewód). Teraz rozcinamy kubeczek i wyjmujemy zawartość. Część znajdująca się w pobliżu wyciągniętej elektrody jest czarna i zawiera dwutlenek manganu wraz z pyłem grafitowym; fragment położony w pobliżu ścianek cynkowego kubka ma jaśniejszy odcień. Cała masa (o konsystencji gęstego ciasta) jest nasączona stężonym roztworem chlorku amonu. Kubek zamyka krążek z tworzywa sztucznego lub warstwa smoły, co zapobiega wysychaniu zawartości. Cynkową blachę po oczyszczeniu zostawiamy w naszej pracowni do dalszego wykorzystania. Zawartość wnętrza baterii mieszamy z niewielką ilością wody (30?50 cm3 na masę wydobytą z jednego ?paluszka?) i ogrzewamy przez kilka minut, po czym sączymy do czystej kolby. W otrzymanym przesączu potwierdzimy obecność chlorku amonu. Osad odkładamy do dalszych badań.
Na początek anion chlorkowy Cl?. Do jego wykrywania stosuje się czułą reakcję z roztworem azotanu(V) srebra AgNO3. Podzielmy przesącz na dwie części i do jednej z nich dodajmy nieco roztworu lapisu o stężeniu ok. 5%. Natychmiast wytrąca się biały, serowaty osad chlorku srebra:
Ag+ + Cl- ? AgCl?
Osad pozostawiony na świetle po kilku minutach ciemnieje z powodu fotochemicznego rozkładu soli srebra. Dodatkową próbą potwierdzającą tożsamość substancji jest roztworzenie świeżo strąconego osadu w wodzie amoniakalnej NH3aq lub w roztworze tiosiarczanu sodu Na2S2O3. Podczas reakcji tworzą się rozpuszczalne w wodzie kompleksowe związki srebra. W drugiej porcji przesączu wykryjemy jony amonowe NH4+ za pomocą niezwykle czułej reakcji z użyciem odczynnika Nesslera ? w 1856 roku niemiecki chemik Julius Neßler (1827?1905) jako pierwszy zastosował go w analizie. Do wykonania odczynnika potrzebne będą roztwory: jodku potasu KI oraz azotanu(V) rtęci(II) Hg(NO3)2 o stężeniach ok. 5%. Zachowajmy niezbędną ostrożność, posługując się toksycznymi związkami rtęci! Na początku wytrącamy pomarańczowoczerwony osad jodku rtęci(II) HgI2. Następnie kroplami dodajemy więcej roztworu jodku potasu (aż do całkowitego rozpuszczenia osadu). Powstający związek kompleksowy ? tetrajodortęcian(II) potasu ? to odczynnik Nesslera:
Hg(NO3)2 + 2KI ? HgI2? + 2KNO3
HgI2 + 2KI ? K2HgI4
Teraz do kolby z porcją przesączu wlewamy otrzymany odczynnik i alkalizujemy mieszaninę kilkoma cm3 roztworu wodorotlenku sodu NaOH. Powstaje żółtopomarańczowe zabarwienie zawartości kolby lub, w przypadku większego stężenia jonów amonowych, wytrąca się czerwonobrunatny osad kompleksowego połączenia rtęci o dość skomplikowanej budowie:
NH4Cl + 2K2HgI4 + 4NaOH ? [OHg2NH2]I + KCl + 4NaI + 3H2O
Bardzo czuła próba Nesslera służy do wykrywania nawet śladowych ilości soli amonowych lub amoniaku w wodzie. Kolej na dwutlenek manganu MnO2. Próbą pozwalającą wykryć związki manganu jest reakcja z dwutlenkiem ołowiu PbO2 w środowisku stężonego roztworu kwasu azotowego(V) HNO3. Ze względu na konieczność operowania silnymi utleniaczami próbę przeprowadzimy w skali mikro. Do odrobiny osadu z sączka umieszczonego w probówce dodajemy szczyptę PbO2 i około 1 cm3 stężonego roztworu HNO3. Po ostrożnym ogrzaniu do wrzenia czekamy, aż zawartość wystygnie. Następnie dodajemy kroplami nieco wody. Ciecz nad osadem przybiera czerwonofioletowe zabarwienie, przypominające kolor roztworu? Tak! Nadmanganianu potasu KMnO4. Rzeczywiście, pod wpływem utleniacza silniejszego niż MnO2 w reakcji powstają jony MnO4-:
2MnO2 + 3PbO2 + 4H+ ? 2MnO4- + 3Pb2+ + 2H2O
Modyfikacje ogniwa Leclanchégo
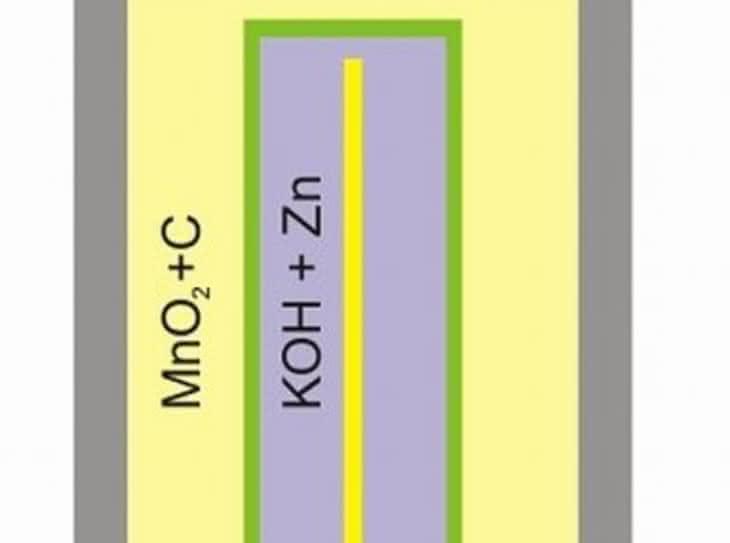
Liczące sobie już prawie 150 lat ogniwo Leclanchégo nadal nie wychodzi z użycia ze względu na prostotę konstrukcji i niską cenę wyrobu. W ciągu swej kariery doczekało się wielu modyfikacji zwiększających żywotność oraz pojemność. Jednym ze sposobów wydłużenia czasu pracy ogniwa jest dodanie chlorku cynku ZnCl2 do pasty wypełniającej kubek. Ogniwa o tej konstrukcji często noszą angielską nazwę Heavy Duty i (jak sama nazwa wskazuje) przeznaczone są do zasilania urządzeń bardziej wymagających energetycznie. Chlorek amonu jako sól słabej zasady i mocnego kwasu hydrolizuje, wytwarzając kwaśny odczyn roztworu wypełniającego ogniwo. Cynk w tym środowisku ulega roztwarzaniu przez cały czas, nawet wtedy, gdy z układu nie czerpiemy energii elektrycznej. Aby zapobiec niekorzystnemu zjawisku, stosuje się rozmaite zabiegi prowadzące do ograniczenia zużywania metalu w stanie bezczynności ogniwa. Jednym z nich jest amalgamowanie (pokrywanie rtęcią tworzącą roztwór z cynkiem ?amalgamat) wewnętrznej powierzchni cynkowego kubeczka. Amalgamat cynku praktycznie nie reaguje z kwasami, zachowując jednak wszystkie własności elektrochemiczne czystego metalu. Ze względu na regulacje prawne dotyczące ochrony środowiska coraz rzadziej stosuje się ten sposób zwiększenia trwałości ogniw (na ogniwach bezrtęciowych można spotkać napis ?0% mercury? lub ?mercury free?). Przełomem w dziedzinie baterii jednorazowego użytku było skonstruowanie w 1955 roku ogniwa alkalicznego. Wynalazek zawdzięczamy kanadyjskiemu inżynierowi Lewisowi Frederickowi Urry?emu (1927?2004), pracownikowi obecnej firmy Energizer. Konstrukcja Urry?ego jest nieco odmienna od budowy ogniwa Leclanchégo. Przede wszystkim nie znajdziemy w niej ani grafitowej katody, ani cynkowego kubeczka. Obie elektrody występują w postaci wilgotnych, odseparowanych od siebie past (substancje zagęszczające plus reagenty: katoda wykonana jest z mieszaniny dwutlenku manganu z grafitem, zaś anoda z pyłu cynkowego zmieszanego z wodorotlenkiem potasu). Jedynie wyprowadzenia biegunów ogniwa wykonane są z metalu. Natomiast przebiegające na elektrodach reakcje zachodzą podobnie:
(-)Zn0 ? ZN2+ + 2e-
(+) 2MnO2 + 2H2O + 2e- ? 2MnO(OH) + 2OH-
Jony cynku reagują następnie z anionami wodorotlenowymi, tworząc połączenie kompleksowe:
Zn2+ + 4OH- ? [Zn(OH)4]2-
Ogniwa alkaliczne cechują się znacznie lepszymi właściwościami użytkowymi w porównaniu do klasycznych ogniw Leclanchégo, a przede wszystkim możliwością czerpania prądu o większym natężeniu i dłuższym czasem życia. W oznaczeniach ogniw alkalicznych (naniesionych na obudowie wyrobu) jest obecna litera L, np. LR6. Eksploatując ogniwa Leclanchégo lub alkaliczne, musimy pamiętać, aby po wyczerpaniu nie pozostawić ich w zasilanym urządzeniu. Agresywne środowisko wewnętrzne nieubłaganie atakuje powłokę aż do całkowitego ?przeżarcia?. Wyciek elektrolitu może uszkodzić sprzęt elektroniczny. Z tych samych względów nie wyrzucajmy zużytych ogniw do śmieci, ale zanieśmy je do punktów zbiórek (możliwe, że specjalnie oznaczoną skrzynkę znajdziecie nawet w swojej szkole). Pamiętajmy również, że ogniwa jednorazowe nie nadają się do regeneracji i pod żadnym pozorem nie próbujmy ich ładować ? wydzielające się produkty gazowe mogą rozerwać obudowę. Miejmy również świadomość, że problematyka ogniw używanych współcześnie została zaledwie zarysowana. Oprócz omówionych istnieje cała gama innych konstrukcji (np. ogniwa litowe), nie mówiąc już o bateriach nadających się do powtórnego ładowania (więcej o nich w odcinku poświęconym akumulatorom). Podczas następnego spotkania zbudujemy kilka ogniw zupełnie innego rodzaju.