Barwy elektrolizy - e-suplement

Powstające jednocześnie kationy wodorowe powodują zakwaszenie roztworu w sąsiedztwie tej elektrody.
Na katodzie przebiega proces redukcji połączony z wydzielaniem wolnego wodoru:
(-) Katoda: 2H2O + 2e- - H2+ 2OH-
Tworzące się aniony wodorotlenowe powodują wzrost pH w przestrzeni katodowej.
Elektroliza wodnego roztworu azotanu(V) potasu KNO3 z dodatkiem wskaźnika pozwoli zaobserwować zmiany odczynu w okolicach elektrod. Do przeprowadzenia prób potrzebne będzie jeszcze źródło prądu (np. płaska bateria typu 3R12 o napięciu 4,5V) oraz dwa połączone z jego biegunami gwoździe. Doświadczenia będziemy prowadzić na szalkach Petriego.
W pierwszej próbie użyjemy błękitu bromotymolowego, barwiącego się na żółto w roztworze o odczynie kwaśnym i na niebiesko w zasadowym. W roztworze o odczynie obojętnym wskaźnik przybiera zielone zabarwienie (fotografia 1). Po napełnieniu szalki roztworem KNO3 wraz z dodatkiem błękitu bromotymolowego (fotografia 2) zanurzamy w niej elektrody połączone z biegunami źródła prądu (fotografia 3). Po chwili roztwór w pobliżu elektrody dodatniej staje się żółty, zaś w okolicy elektrody ujemnej - wyraźnie niebieski (fotografia 4).
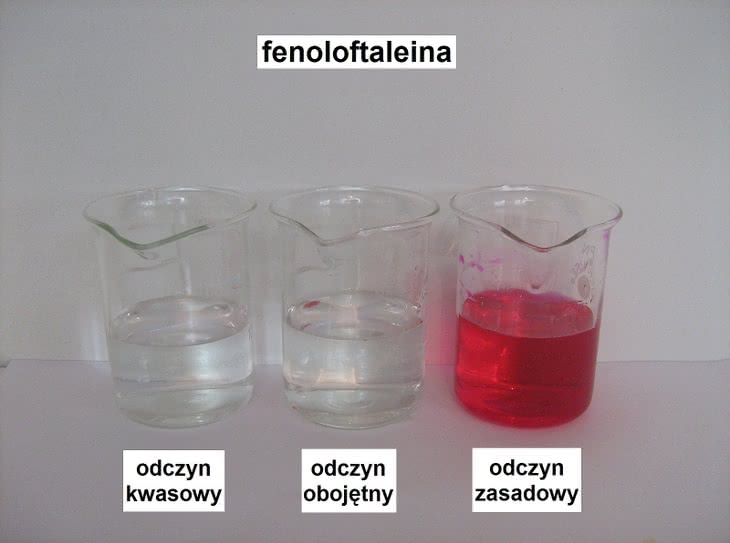
Kolejny popularny wskaźnik to fenoloftaleina, przyjmująca charakterystyczną malinową barwę w roztworach o odczynie zasadowym (fotografia 5). Roztwór KNO3 z jej dodatkiem podczas elektrolizy przybiera malinowe zabarwienie w pobliżu elektrody ujemnej (fotografia 6).
Oranż metylowy barwi się na kolor pomarańczowoczerwony w roztworach o odczynie kwasowym, w obojętnym i zasadowym pozostaje żółty (fotografia 7). Prowadzenie elektrolizy roztworu azotanu(V) potasu z dodatkiem tego wskaźnika powoduje powstanie czerwonego zabarwienia w okolicach elektrody połączonej z dodatnim biegunem źródła (fotografia 8).
Do stwierdzenia zmian odczynu roztworu podczas elektrolizy mogą służyć również papierki wskaźnikowe (fotografia 9). Na papierku zwilżonym roztworem KNO3 kładziemy elektrody połączone z biegunami baterii. Stwierdzamy, że w pobliżu elektrody dodatniej wskaźnik zmienia kolor na czerwony (zakwaszenie roztworu), zaś w okolicy elektrody ujemnej ? na niebieski (odczyn zasadowy). Zmiany barw widoczne są na fotografii 10.
Elektrolityczne pismo
Zmiany barwy wskaźników (oraz niektórych innych związków) podczas elektrolizy wykorzystamy w widowiskowym eksperymencie, zwanym ?elektrolitycznym pismem?. Kawałek kartki nasycamy roztworem azotanu(V) potasu KNO3 z dodatkiem fenoloftaleiny. Papier kładziemy na metalowej płytce połączonej z dodatnim biegunem źródła prądu, zaś drugi biegun łączymy z metalowym pręcikiem (fotografia 11). Przy przesuwaniu pręcikiem po powierzchni kartki pojawiają się czerwone linie (fotografia 12). Wywołuje je zmiana barwy fenoloftaleiny w roztworze o odczynie zasadowym, powstającym w pobliżu naszego ?elektrycznego pióra? (elektrody ujemnej). Zjawisko umożliwia pisanie, np. liter MT (fotografia 13).
Używając roztworu jodku potasu z dodatkiem zawiesiny skrobi można pisać ?atramentem? w ciemnym kolorze. Musimy tylko zmienić sposób połączenia biegunów źródła z płytką (teraz łączymy ją z ?minusem?) oraz pręcikiem (?plus?). Przesuwanie elektrody po powierzchni kartki powoduje powstanie ciemnych kresek (fotografia 14), również układających się w napis MT (fotografia 15). Kolor ?atramentu? pochodzi od kompleksowego połączenia wolnego jodu (fluorowiec wydziela się na elektrodzie dodatniej) ze skrobią.