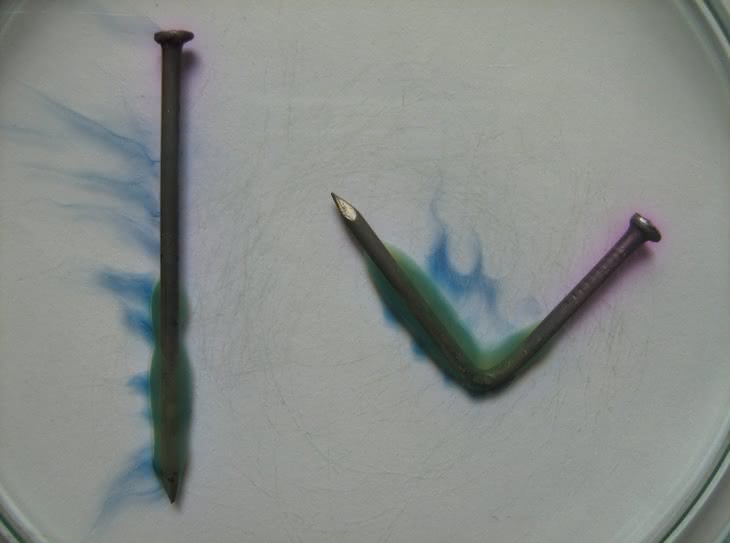Elektrochemiczna korozja stali w odczynniku ferroksylowym

Do 100 cm3 roztworu chlorku sodu dodajemy po 1-2 cm3 każdego z pozostałych roztworów, a mieszaninę ogrzewamy. Następnie dodajemy 3-5g żelatyny, co umożliwi uzyskanie wyraźniejszych efektów doświadczeń (próby można prowadzić również bez tego dodatku). Po rozpuszczeniu żelatyny wylewamy roztwór na płaską powierzchnię (np. na szalkę Petriego) i umieszczamy w nim uprzednio przygotowane próbki. W pierwszym eksperymencie zaobserwujemy wpływ odczynnika ferroksylowego na stalowe gwoździe połączone z innymi metalami: cynkiem oraz miedzią - pamiętajmy o dokładnym oczyszczeniu powierzchni przed doświadczeniem (fotografia 1). Po napełnieniu szalki Petriego cieczą (fotografia 2) zanurzamy do niej gwoździe owinięte cynkową blaszką i miedzianym drucikiem (fotografia 3). Pierwsze oznaki korozji występują prawie natychmiast (fotografia 4) - w pobliżu gwoździ roztwór zaczyna się zabarwiać na niebiesko i różowo.
Po kilku godzinach zmiany widoczne są w pełni (fotografie 5 i 6). Różowa barwa wskazuje miejsca, w których pojawiły się jony wodorotlenowe - są to tzw. obszary katodowe (dochodzi w nich do redukcji tlenu rozpuszczonego w wodzie): (+) Katoda: O2 + 2H2O + 4e- - 4OH- Zabarwienie niebieskie oraz zielone (produkty dalszych przemian jonów żelaza) wyznacza rejony, w których pojawiły się kationy Fe2+. Te rejony zwane są obszarami anodowymi - dochodzi w nich do utleniania i niszczenia metalu: (-) Anoda: Fe0 - Fe2+ + 2e- Powierzchnia gwoździa połączonego z blaszką cynkową jest obszarem katodowym i nie ulega zniszczeniu. Jako metal aktywniejszy, cynk chroni żelazo i sam się roztwarza - powstały związek cynku ma białą barwę i jest słabo widoczny. Na powierzchni gwoździa połączonego z drutem miedzianym tworzą się niebieskozielone osady związków żelaza. Oznaczają one rejony wzmożonego niszczenia stali. Obszar katodowy (różowe zabarwienie) występuje natomiast w pobliżu miedzi, która jest metalem mniej aktywnym od żelaza.
W kolejnym eksperymencie użyjemy dwóch gwoździ, z których jeden poddamy obróbce mechaniczne - zgięciu (fotografia 7). Również w tym przypadku po krótkim czasie występują wyraźne objawy zachodzącej korozji (fotografie 8 i 9). Zgięty gwóźdź koroduje właśnie w rejonie uszkodzenia (obszar anodowy), natomiast drugi - w pobliżu ostrza (także poddanego obróbce mechanicznej). W pobliżu łebków możemy zauważyć różowo zabarwione obszary katodowe. Wzmożona korozja uszkodzonych fragmentów przedmiotów stalowych spowodowana jest lokalnym naruszeniem struktury krystalicznej metalu.
Korozja w kropli
Kolejną próbę wykonujemy na powierzchni stalowej płytki, za pomocą pipetki nanosząc na nią dużą kroplę odczynnika ferroksylowego (fotografia 10 i 11). Pierwsze oznaki korozji występują szybko w postaci niebieskiej plamki w środkowej części kropli (fotografia 12). O rozwoju korozji świadczy zabarwienie powierzchni stalowej płytki - czerwonawe na obrzeżach kropli odczynnika ferroksylowego i niebieskozielone w jej centrum (fotografia 13). Po pewnym czasie stal pokrywa się brunatnym nalotem rdzy (fotografia 14).
Wykonane doświadczenie sygnalizuje pewien paradoks procesu korozji - w miejscach dużego dostępu tlenu (obrzeża kropli) pojawiają się obszary katodowe (różowa barwa), gdzie żelazo nie ulega zniszczeniu. Natomiast w miejscach o niewielkim dostępie tego gazu dochodzi do wzmożonej korozji stali (obszary anodowe), co tłumaczy na przykład fakt "zapiekania się" gwintów śrub. Wyniki wszystkich doświadczeń widoczne są na fotografii 15.