Celne strzały w chorobę
W 1998 r., czyli w czasach gdy amerykański badacz, Kevin Tracey (1), przeprowadzał swoje eksperymenty na szczurach, nie widziano jakiegokolwiek związku pomiędzy nerwem błędnym a układem odpornościowym w organizmie. Uważano takie połączenie za wręcz niemożliwe.
Tracey był jednak pewien istnienia "interfejs" łączącego nerwy z immunologią. Połączył ręczny stymulator impulsów elektrycznych z nerwem zwierzęcia i potraktował je sekundowymi "strzałami". Następnie podał szczurowi TNF (czynnik martwicy nowotworu), proteinę związaną z procesem zapalnym, zarówno u zwierząt, jak i u ludzi. Zwierzę powinno było popaść w ostry stan zapalny w ciągu godziny, jednak po jego zbadaniu stwierdzono, że TNF został w 75% zablokowany.
Okazało się, że system nerwowy zadziałał jak terminal komputerowy, za pomocą którego można zapobiec infekcji, zanim w ogóle się zacznie, lub też zatrzymać jej rozwój.
Odpowiednio zaprogramowane impulsy elektryczne, którymi traktuje się układ nerwowy, potrafią zastąpić działanie drogich i nieobojętnych dla zdrowia pacjenta leków.
Pilot do ciała
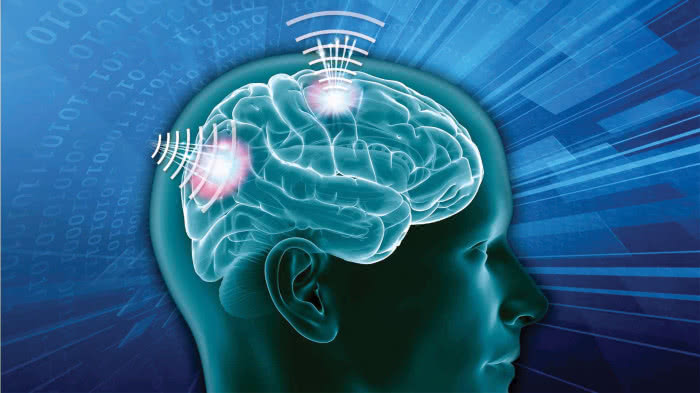
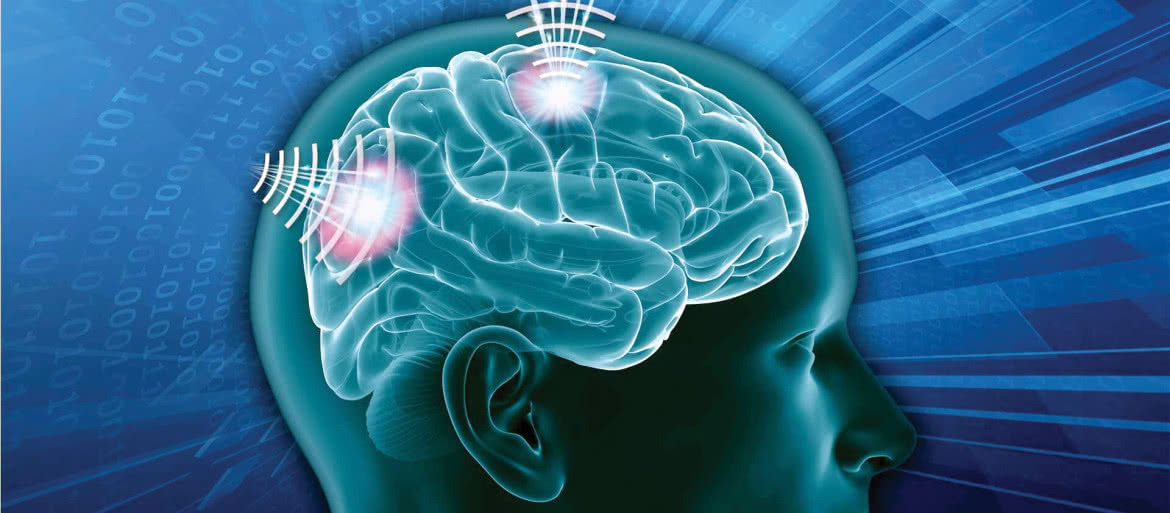
Odkrycie to otworzyło nową gałąź nazwaną bioelektroniką, w której poszukuje się coraz bardziej miniaturyzowanych rozwiązań technicznych stymulacji organizmu w celu wywołania ściśle zaplanowanych reakcji. Technika ta wciąż jest w powijakach. W dodatku istnieją spore obawy związane z bezpieczeństwem obwodów elektronicznych. Jednak w porównaniu z farmaceutykami ma ona ogromne zalety.
W maju 2014 r. Tracey powiedział w rozmowie z "New York Timesem", że techniki bioelektroniczne mogą zastąpić z powodzeniem przemysł farmaceutyczny i w ostatnich latach często to powtarza.
Założona przez niego firma, SetPoint Medical (2), dwa lata temu po raz pierwszy zastosowała nową terapię w grupie dwunastu ochotników z Bośni i Hercegowiny. Wszczepiono im w szyję maleńkie stymulatory nerwu błędnego, emitujące sygnały elektryczne. U ośmiu osób próba uwieńczona została sukcesem - dotkliwy ból ustąpił, poziom białek prozapalnych powrócił do normy, a, co najważniejsze, nowa metoda nie pociągnęła za sobą poważniejszych skutków ubocznych. Obniżała poziom TNF o ok. 80%, nie eliminując go zupełnie, jak ma to miejsce w przypadku farmakoterapii.
Po latach badań laboratoryjnych, w 2011 r. SetPoint Medical, w którą zainwestował koncern farmaceutyczny GlaxoSmithKline, rozpoczęła kliniczne testy implantów stymulujących nerwy w celu walki ze schorzeniami. Dwie trzecie pacjentów objętych badaniami, którym wszczepiono w szyje ponad dwucentymetrowe implanty połączone z nerwem błędnym, wykazało poprawę, zanik bólu i opuchlizny. Naukowcy mówią, że to dopiero początek i mają plany leczenia za pomocą elektrycznej stymulacji kolejnych chorób, np. astmy, cukrzycy, epilepsji, bezpłodności, otyłości i nawet raka. Oczywiście także takich infekcji, jak COVID-19.
Jako koncepcja, bioelektronika jest prosta. Mówiąc w skrócie, polega na przekazywaniu układowi nerwowemu sygnałów nakazujących organizmowi naprawę.
Jednak jak zwykle problemem są szczegóły, np. właściwa interpretacja i tłumaczenie elektrycznego języka układu nerwowego. Kolejnym wyzwaniem jest bezpieczeństwo. Mówimy tu przecież o urządzeniach elektronicznych, połączonych bezprzewodowo w sieci (3), a co za tym idzie - potencjalnie narażonych na ataki hakerskie.
Jak mówi Anand Raghunathan, profesor inżynierii elektrycznej i komputerowej na Uniwersytecie Purdue, bioelektronika "daje mi pilota do czyjegoś ciała". Poważnym wyzwaniem jest również miniaturyzacja, w tym także techniki skutecznego łączenia z sieciami neuronów, które pozwalałyby na uzyskanie odpowiednich ilości danych.
Bioelektroniki nie należy przy tym mylić z biocybernetyką (czyli cybernetyką biologiczną), ani z bioniką (która wyodrębniła się z biocybernetyki). Są to osobne dyscypliny naukowe. Ich wspólnym mianownikiem jest odwoływanie się do wiedzy biologicznej i technicznej.
Kontrowersje wokół dobrych wirusów aktywowanych optycznie
Dziś naukowcy tworzą implanty, które mogą komunikować się bezpośrednio z układem nerwowym, podejmując próby walki z różnymi problemami zdrowotnymi, od raka do przeziębienia.
Gdyby badacze odnieśli sukces i bioelektronika stała się szeroko rozpowszechniona, miliony ludzi mogłyby pewnego dnia chodzić z podłączonymi do swoich systemów nerwowych komputerami.
W sferze marzeń, ale nie zupełnie nierealnych, pozostają np. systemy wczesnego ostrzegania, które za pomocą sygnałów elektrycznych dokonują natychmiastowej detekcji "wizyty" takiego choćby koronawirusa w organizmie i wysyłają na agresora broń (farmakologiczną czy nawet nanoelektroniczną), póki nie zaatakuje jeszcze całego ustroju.
Badacze zmagają się z wypracowaniem metody, która pozwoli nadać sens sygnałom pochodzącym jednocześnie z setek tysięcy neuronów. Dokładna rejestracja i analiza są dla bioelektroniki niezbędne, aby naukowcy mogli zidentyfikować rozbieżności między podstawowymi sygnałami neuronowymi u osób zdrowych, a tymi, które są wytwarzane przez kogoś z określoną chorobą.
Konwencjonalne podejście do rejestrowania sygnałów neuronowych polega na wykorzystaniu maleńkich sond z elektrodami wewnątrz, zwanych patch clampami. Badacz np. raka prostaty może przymocować patch clampy do nerwu związanego z prostatą u zdrowej myszy i rejestrować aktywność. To samo można by zrobić ze stworzeniem, którego prostata została genetycznie zmodyfikowana do produkcji złośliwych guzów. Porównanie danych wyjściowych z obu tych metod pozwoliłoby na określenie, jak różne są sygnały nerwowe u myszy z rakiem. Na podstawie takich danych można by z kolei zaprogramować sygnał korygujący w urządzeniu bioelektronicznym do leczenia raka.
Ale patch clampy mają wady. Mogą pobierać próbki tylko z jednej komórki naraz, a zatem nie gromadzą wystarczającej ilości danych, aby zobaczyć całościowy obraz. Jak mawia Adam E. Cohen, wykładowca chemii i fizyki na Harvardzie, "to jak próba obejrzenia opery przez słomkę".
Cohen, ekspert w rozwijającej się dziedzinie zwanej optogenetyką, uważa, że jest w stanie przezwyciężyć ograniczenia związane z zewnętrznymi łatkami. Jego badania próbują wykorzystać optogenetykę do rozszyfrowania neuronalnego języka choroby. Problem polega na tym, że aktywność neuronowa nie pochodzi z głosów poszczególnych neuronów, ale z całej ich orkiestry działającej w stosunku do siebie. Patrzenie na jeden po drugim nie daje całościowego widoku.
Optogenetyka powstała w latach 90. Naukowcy wiedzieli, że białka, zwane opsynami, w bakteriach i glonach wytwarzają energię elektryczną pod wpływem światła. Optogenetyka wykorzystuje ten mechanizm.
Geny opsynowe są wprowadzane do DNA nieszkodliwego wirusa, który następnie jest wstrzykiwany do mózgu lub nerwu obwodowego badanego obiektu. Zmieniając sekwencję genetyczną wirusa, badacze kierują go na określone neurony, np. te odpowiedzialne za odczucie zimna lub bólu, albo na regiony mózgu, o których wiadomo, że odpowiadają za określone działania lub zachowania.
Następnie przez skórę lub czaszkę wprowadza się światłowód, który przepuszcza światło z jego końcówki - do miejsca, w którym znajduje się wirus. Światło światłowodu aktywuje opsynę, która z kolei przewodzi ładunek elektryczny zmuszający neuron do "strzału" (4). Naukowcy potrafią w ten sposób kontrolować reakcje organizmu myszy, indukując sen i agresję na polecenie.
Zanim jednak opsyny i optogenetyka zostaną wykorzystane do aktywacji neuronów biorących udział w określonych dolegliwościach, specjaliści muszą ustalić nie tylko, które neurony są odpowiedzialne za daną chorobę, ale także jak ta choroba komunikuje się z układem nerwowym.
Podobnie jak komputery, neurony mówią językiem binarnym, przy czym słownictwo opiera się na tym, czy ich sygnał jest włączony, czy wyłączony. Kolejność, odstępy czasu i intensywność tych zmian decydują o tym, jak przekazywana jest informacja. Jeśli jednak każdą chorobę można uznać za mówiącą w swoim własnym języku, potrzebny jest tłumacz.
Cohen i jego koledzy uznali, że optogenetyka sobie z tym poradzi. Zaprojektowali więc proces w odwrotnej kolejności - zamiast używać światła do aktywacji neuronów, używają światła do zapisu ich aktywności.
Opsyny być może są drogą leczenia wszystkich rodzajów chorób, ale naukowcy najprawdopodobniej będą musieli opracować urządzenia bioelektroniczne, które nie będą z nich korzystać. Użycie genetycznie zmodyfikowanych wirusów stanie się bowiem trudne do zaakceptowania dla władz i społeczeństwa. Ponadto technika opsynowa opiera się na terapii genowej, która nie odniosła jeszcze przekonujących sukcesów w badaniach klinicznych, jest bardzo kosztowna i wydaje się, że wiąże się z poważnym ryzykiem dla zdrowia.
Cohen wspomina o dwóch alternatywach. Jedna dotyczy cząsteczek, które zachowują się jak opsyny. Druga wykorzystuje RNA, które przekształca się w białko podobne do opsyn - ponieważ nie zmienia DNA, nie występuje ryzyko związane z terapią genową. Nadal głównym problemem jest dostarczenie światła na miejsce. Istnieją projekty implantów do mózgu z wbudowanym laserem, ale np. Cohen uważa, że bardziej realne jest stosowanie zewnętrznych źródeł światła.
W dłuższej perspektywie bioelektronika (5) obiecuje kompleksowe rozwiązanie wszystkich problemów zdrowotnych, z jakimi boryka się ludzkość. Na razie to mocno eksperymentalna dziedzina.
Niewątpliwie jednak bardzo ciekawa.