Z atomem przez wieki - część 3

Atomowa lawina
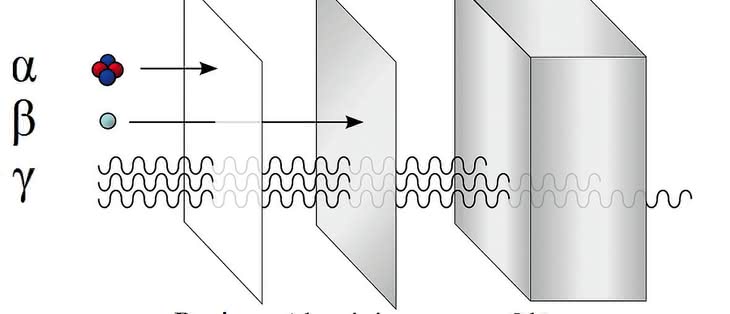
Odkrycie zjawiska promieniotwórczości, które zapoczątkowało wyjaśnianie tajemnic atomu, początkowo zagroziło fundamentowi chemii - prawu okresowości. W krótkim czasie zidentyfikowano kilkadziesiąt substancji promieniotwórczych. Niektóre z nich miały te same właściwości chemiczne mimo różnych mas atomowych, inne zaś, o jednakowych masach - różne własności. Ponadto w tym rejonie tablicy Mendelejewa, w którym powinny się one znaleźć ze względu na swe ciężary, nie było aż tylu pustych miejsc, aby pomieścić je wszystkie. Układ okresowy ginął pod lawiną odkryć.
Jądro atomu
Jest ono 10-100 tys. razy mniejsze od całego atomu. Gdyby jądro atomu wodoru powiększyć do rozmiarów kulki o średnicy 1 cm i ustawić ją na środku boiska piłkarskiego, wtedy elektron (mniejszy niż główka od szpilki) znajdowałby się w okolicy bramki (ponad 50 m).
W jądrze skupiona jest praktycznie cała masa atomu, np. dla złota to prawie 99,98%. Wyobraźmy sobie sześcian zbudowany z tego metalu i ważący 19,3 tony. Wszystkie jądra atomów złota mają łączną objętość wynoszącą mniej niż 1/1000 mm3 (kuleczka o średnicy mniejszej niż 0,1 mm). Atom jest zatem przeraźliwie pusty. Obliczenie gęstości materii jądra pozostawiam Czytelnikom.
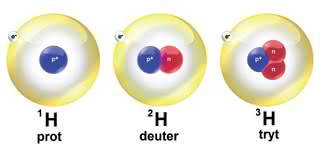
Rozwiązanie tego problemu znalazł w roku 1910 Frederick Soddy. Wprowadził pojęcie izotopów, czyli odmian tego samego pierwiastka różniących się masą atomową (1). Zakwestionował w ten sposób kolejny postulat Daltona - od tej pory pierwiastek chemiczny nie musiał już być złożony z atomów o jednakowej masie. Hipoteza izotopów, po doświadczalnym potwierdzeniu (spektrograf masowy, 1911 r.), pozwoliła również wyjaśnić ułamkowe wartości mas atomowych niektórych pierwiastków - większość z nich jest mieszaniną wielu izotopów, a masa atomowa to średnia ważona mas wszystkich z nich (2).
Składniki jądra
Kolejny uczeń Rutherforda, Henry Moseley, w 1913 r. badał promieniowanie rentgenowskie emitowane przez znane pierwiastki. W przeciwieństwie do skomplikowanych widm optycznych, widmo rentgenowskie jest bardzo proste - każdy z pierwiastków wysyła tylko dwie fale, których długości w prosty sposób można powiązać z ładunkiem jądra jego atomu.
Umożliwiło to po raz pierwszy podanie faktycznej liczby istniejących pierwiastków, a także ustalenie, ilu z nich jeszcze brakuje do zapełnienia luk w układzie okresowym (3).
Cząstkę będącą nośnikiem ładunku dodatniego nazwano protonem (gr. proton = pierwszy). Od razu wyłonił się kolejny problem. Masa protonu jest w przybliżeniu równa 1 u. Wobec tego, w jaki sposób jądro atomu sodu o ładunku równym 11 jednostek ma masę równą 23 u? Podobnie oczywiście jest i w przypadku pozostałych pierwiastków. Muszą zatem istnieć również inne cząstki obecne w jądrze i nieobdarzone ładunkiem. Początkowo fizycy przypuszczali, że są to silnie związane protony z elektronami, ale ostatecznie dowiedziono istnienia nowej cząstki - neutronu (łac. neuter = obojętny). Odkrycia tej cząstki elementarnej (tak zaczęto nazywać podstawowe "cegiełki", z których zbudowana jest cała materia) dokonał w roku 1932 angielski fizyk James Chadwick.
Protony i neutrony mogą przekształcać się w siebie nawzajem. Fizycy przyjmują, że są one formami cząstki zwanej nukleonem (łac. nucleus = jądro).
Ponieważ jądro najprostszego izotopu wodoru to proton, widać że William Prout w swojej "wodorowej" hipotezie budowy atomu nie pomylił się zbytnio (patrz: "Z atomem przez wieki - część 2"; "Młody Technik" nr 8/2015). Początkowo nawet wahano się pomiędzy nazwami proton i "prouton".
Nie wszystko dozwolone
Model Rutherforda już w chwili powstania miał "wadę wrodzoną". Zgodnie z prawami elektrodynamiki Maxwella (potwierdzonymi przez działającą już wtedy radiofonię) elektron poruszający się po okręgu musi wypromieniowywać falę elektromagnetyczną.
W ten sposób traci energię, co w konsekwencji kończy się jego upadkiem na jądro. W normalnych warunkach atomy nie promieniują (widma powstają po ogrzaniu do wysokich temperatur) i nie obserwuje się atomowych katastrof (szacowany czas życia elektronu wynosił mniej niż jedną milionową sekundy).
Model Rutherforda tłumaczył wynik doświadczenia z rozpraszaniem cząstek a, ale nadal nie był prawdziwy.
W roku 1913 "przyzwyczajono" się już do faktu, że energia w mikroświecie nie jest pobierana i wysyłana w dowolnej ilości, lecz w porcjach zwanych kwantami. Na tej podstawie Max Planck wyjaśnił charakter widm promieniowania wysyłanego przez ogrzane ciała (1900 r.), a Albert Einstein (1905 r.) - zagadki efektu fotoelektrycznego, czyli emisji elektronów przez oświetlane metale (4).
28-letni duński fizyk Niels Bohr poprawił model atomu Rutherforda. Założył, że elektrony poruszają się tylko po takich orbitach, które spełniają pewne warunki dotyczące ich energii. Ponadto elektrony nie wysyłają promieniowania podczas ruchu, a energia jest pochłaniana i emitowana jedynie podczas przeskoków pomiędzy orbitami. Założenia były sprzeczne z klasyczną fizyką, ale uzyskane na ich podstawie wyniki (rozmiar atomu wodoru oraz długości linii jego widma) okazywały się zgodne z doświadczeniem. Narodził się nowy model atomu.
Niestety, rezultaty były prawidłowe tylko dla atomu wodoru (ale nie wyjaśniały wszystkich obserwacji widma). Dla innych pierwiastków wyniki obliczeń nie odpowiadały rzeczywistości. Fizycy nadal zatem nie posiadali teoretycznego modelu atomu.
Tajemnice zaczęły się wyjaśniać po jedenastu latach. Praca doktorska francuskiego fizyka Ludwika de Broglie'a dotyczyła własności falowych cząstek materialnych. Dowiedziono już, że światło oprócz typowych cech fali (dyfrakcja, załamanie) zachowuje się również jak zbiór cząstek - fotonów (np. zderzenia sprężyste z elektronami). Ale obiekty obdarzone masą? Założenie wydawało się mrzonką księcia, który zapragnął zostać fizykiem. Jednak w roku 1927 wykonano doświadczenie potwierdzające hipotezę de Broglie'a - strumień elektronów ulegał dyfrakcji na krysztale metalu (5).
Skąd się wzięły atomy?
Jak wszystko: z Wielkiego Wybuchu. Fizycy sądzą, że już po ułamku sekundy od "chwili zero" powstały protony, neutrony i elektrony, czyli składniki atomów. Po kilku minutach (wraz z ekspansją Wszechświat stygł i zmniejszała się gęstość materii) nukleony łączyły się ze sobą, tworząc jądra pierwiastków innych niż wodór. W największej ilości powstał hel, a także ślady kolejnych trzech pierwiastków. Dopiero po 100 tys. lat warunki pozwoliły na związanie elektronów z jądrami - powstały pierwsze atomy. Na kolejne przyszło długo poczekać. Przypadkowe fluktuacje gęstości spowodowały powstanie zagęszczeń, które gdy się już raz pojawiły, ściągały do siebie coraz więcej materii. Wkrótce w mrokach Wszechświata rozbłysły pierwsze gwiazdy.
Po około miliardzie lat niektóre zaczęły kończyć życie. W jego toku wyprodukowały jądra atomów aż do żelaza włącznie. Teraz, umierając, rozsiewały je po całej okolicy, a z prochów rodziły się nowe gwiazdy. Najbardziej masywne z nich miały efektowny koniec. Podczas wybuchów supernowych jądra były bombardowane taką ilością cząstek, że tworzyły się nawet najcięższe pierwiastki. Z nich powstały nowe gwiazdy, planety, a na niektórych globach - życie.
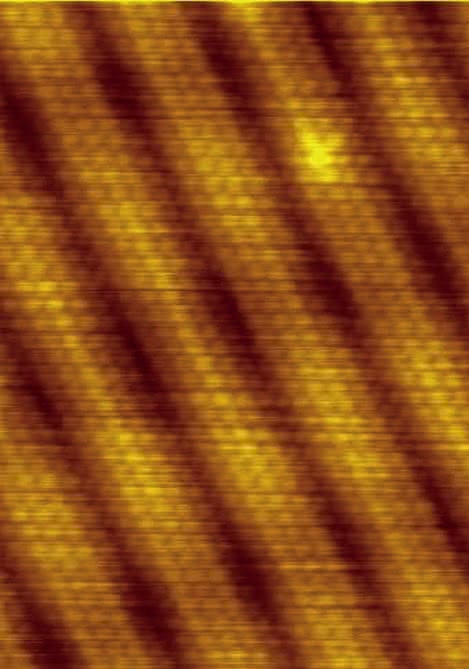
Dowiedziono istnienia fal materii. Elektron w atomie został natomiast potraktowany jako fala stojąca, dzięki czemu nie wypromieniowuje energii. Falowe własności poruszających się elektronów wykorzystano do skonstruowania mikroskopów elektronowych, które po raz pierwszy pozwoliły zobaczyć atomy (6). W kolejnych latach prace Wernera Heisenberga i Erwina Schrödingera (oparte o hipotezę de Broglie'a) umożliwiły opracowanie nowego, w pełni zgodnego z doświadczeniem modelu powłok elektronowych atomu. Ale to zagadnienia wykraczające poza ramy artykułu.
Spełniony sen alchemików
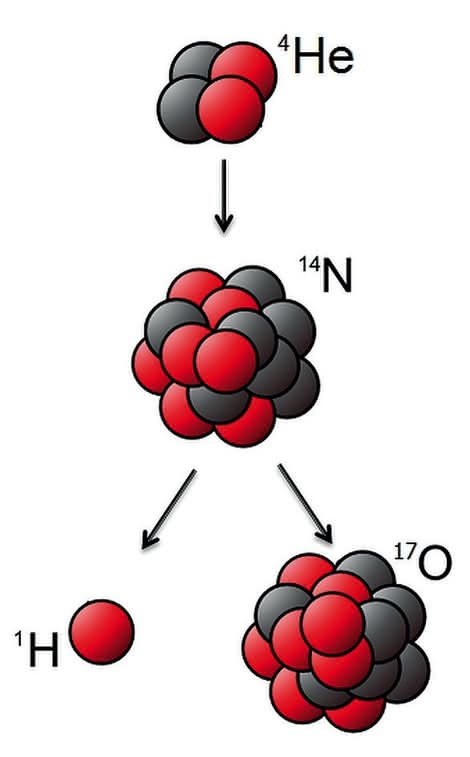
Naturalne przemiany promieniotwórcze, w których tworzyły się nowe pierwiastki, były znane od schyłku XIX wieku. W roku 1919 dokonano tego, co do tej pory potrafiła tylko przyroda. Ernest Rutherford w tym okresie zajmował się oddziaływaniem cząstek a z materią. Podczas prób zauważył, że w wyniku naświetlania gazowego azotu pojawiają się protony.
Wytłumaczeniem zjawiska była tylko reakcja pomiędzy jądrami helu (cząstka a to jądro izotopu tego pierwiastka) oraz azotu (7). W jej wyniku powstają tlen i wodór (proton jest jądrem najlżejszego izotopu). Spełnił się sen alchemików o transmutacji. W kolejnych dziesięcioleciach wytworzono pierwiastki, które nie występują naturalnie w przyrodzie.
Do tego celu nie nadawały się już naturalne preparaty promieniotwórcze emitujące cząstki a (bariera kulombowska ciężkich jąder jest zbyt duża, aby lekka cząstka mogła się do nich zbliżyć). Akceleratory nadające ogromne energie jądrom ciężkich izotopów okazały się "alchemicznymi piecami", w których protoplaści dzisiejszych chemików usiłowali otrzymać "króla metali" (8).
No właśnie, a co ze złotem? Alchemicy jako surowca do jego produkcji najczęściej używali rtęci. Trzeba przyznać, że w tym przypadku mieli nie lada "nosa". Właśnie z rtęci poddanej działaniu neutronów w reaktorze jądrowym po raz pierwszy otrzymano sztuczne złoto. Bryłkę metalu pokazano w 1955 r. na Konferencji Atomowej w Genewie.
Wieść o osiągnięciu fizyków spowodowała nawet krótkie zawirowanie na giełdach światowych, ale sensacyjne doniesienia prasowe zdementowała informacja o cenie tak uzyskanego kruszcu - jest on wielokrotnie droższy od naturalnego złota. Reaktory nie zastąpią więc kopalni szlachetnego metalu. Ale produkowane w nich izotopy i sztuczne pierwiastki (na potrzeby medycyny, energetyki, badań naukowych) są znacznie cenniejsze niż złoto.
Cykl "Z atomem przez wieki" rozpoczął się od przypomnienia, że minione stulecie często nazywano wiekiem atomu. Nie do pominięcia są oczywiście fundamentalne osiągnięcia XX-wiecznych fizyków i chemików dotyczące struktury materii. Jednak w ostatnich latach coraz szybciej poszerza się wiedza o mikroświecie oraz rozwijają technologie pozwalające manipulować pojedynczymi atomami i molekułami. To upoważnia do stwierdzenia, że prawdziwy wiek atomu dopiero przed nami.