Z atomem przez wieki - część 2
... jak zważyć atom
Obecnie wiemy, że masy atomów mieszczą się w przedziale rzędu 10-22÷10-24 g. To liczby trudne do zapisania (22÷24 miejsca po przecinku), jeszcze trudniejsze do nazwania (10-24 to jedna kwadrylionowa, a 10-24 g to joktogram), lecz najtrudniejsze do wyobrażenia. Oczywiście XIX-wieczni uczeni nie zważyli atomów (w potocznym tego słowa znaczeniu), a nawet i dzisiaj pomiar ich masy sprawia dużo kłopotu.
Rozwiązaniem stało się znalezienie odpowiedniego "odważnika". Wybrano atom najlżejszego z pierwiastków - wodoru, któremu przypisano umowną masę równą jedności. Obecnie atomowa jednostka masy jest zdefiniowana inaczej i nazwana unitem (w skrócie "u", od ang. unit = jednostka) lub też daltonem (w skrócie "Da", na cześć Johna Daltona).
Masy atomów innych pierwiastków określano w oparciu o analizę składu ich związków z wodorem. Ponieważ praktycznie wszystkie pierwiastki łączą się z tlenem, wkrótce jako atomową jednostkę masy wybrano 1/16 masy atomu tlenu (atom tlenu jest w przybliżeniu 16 razy cięższy od atomu wodoru).
Jaki ciężki i duży jest atom?
Spróbujmy porównać masę atomu do ciężaru obiektów z naszego otoczenia. Najlżejszy atom wodoru waży ok. 1,66·10-24 g. Aby uzbierał się gram tego pierwiastka, potrzeba ok. 6·1023 jego atomów. Masa Ziemi to 6·1024 kg (szóstka i 24 zera!). Zatem masa atomu wodoru do masy jednego grama ma się tak, jak masa 10-litrowego wiadra wody do masy naszej planety. Najcięższe atomy ważą ok. 250-300 razy więcej, więc ich masa w stosunku do jednego grama to jak ciężar słonia do masy Ziemi. Czyli nadal nic nie znacząca drobina.
Rozmiary atomów są rzędu 10-8 cm, natomiast średnica piłeczki pingpongowej wynosi 4 cm. Jeśli atom powiększylibyśmy do rozmiarów właśnie tej piłeczki, to piłeczka w tej samej skali miałaby średnicę 4 tys. km, czyli prawie 1/3 średnicy Ziemi i nieco więcej, niż wynosi średnica naszego satelity.
Oczywiście dalej nieznane były masy atomów w powszechnie stosowanych jednostkach (np. gramach), ale masy względne (ustalone w porównaniu do wybranego wzorca atomowego) umożliwiły wyznaczenie liczby atomów wchodzących w skład cząsteczek związków oraz wykonywanie obliczeń dotyczących ilości odczynników potrzebnych do reakcji.
Atomy w nauce XIX wieku
Fizycy dość szybko przyjęli i wykorzystali hipotezę atomową w badaniach. Natomiast u chemików długo jeszcze trwało zamieszanie pojęciowe. Nazwa atom u różnych uczonych oznaczała bądź rzeczywiście pojedynczy atom, bądź też cząsteczkę związku chemicznego (powszechnie mówiono np. o "atomach wody"). Jednoznaczne rozróżnienie pojęć atomu i cząsteczki to dopiero II połowa XIX wieku.
Przyjęcie istnienia atomów i cząsteczek o znikomo małych rozmiarach, znajdujących się w ciągłym ruchu oraz oddziałujących na siebie i otoczenie poprzez zderzenia pozwoliło sformułować kinetyczno-molekularną teorię gazów. Obliczenia oparte na poczynionych założeniach (dotyczące np. ciśnienia czy temperatury gazu) okazały się doskonale zgodne z wynikami pomiarów. Był to mocny argument na rzecz istnienia atomów.
Innym, "namacalnym" wręcz dowodem było odkrycie w roku 1827 przez szkockiego botanika Roberta Browna (1) nieustannego ruchu drobin pyłku kwiatowego zawieszonego w wodzie (tzw. ruchy Browna). Wkrótce zauważono, że nie tylko pyłek kwiatowy, ale każde ciało o bardzo niewielkich rozmiarach chaotycznie porusza się w wodzie (nawet po wyeliminowaniu wszystkich możliwych czynników mogących wywołać ten ruch).
W roku 1882 podobny ruch zawiesin w gazach odkrył polski fizyk Łukasz Bodaszewski (obserwując dym tytoniowy). Ruchy Browna wyjaśniono dopiero na początku następnego wieku, a dokonał tego sam Albert Einstein (opierając się na wynikach badań innego polskiego fizyka, Mariana Smoluchowskiego) (2). Za chaotyczny ruch drobin odpowiedzialne są przypadkowe zderzenia z molekułami obecnymi w roztworze.
Atomowa pustka
Porównajmy wnętrze atomu do Układu Słonecznego. Jeśli powiększyć jądro do rozmiarów naszej gwiazdy, w tej samej skali pierwsze planety (czyli krążące wokół jądra elektrony) znajdą się w odległości co najmniej 15-16 mld km, zatem prawie trzykrotnie dalej niż promień orbity Plutona. W porównaniu z atomem Układ Słoneczny jest więc wręcz zatłoczony.
A może jednak jest podzielny?
Podstawowym założeniem teorii atomistycznej była niepodzielność atomu, który wyobrażano sobie jako litą kulkę. Jednak niektórzy uczeni nie mogli pogodzić się z przyjęciem istnieniem tylu rodzajów atomów, ile jest pierwiastków chemicznych.
Angielski lekarz William Prout w roku 1815 postulował przyjęcie założenia, że wszystkie atomy zbudowane są z atomów wodoru. Argumentował, że masy atomów w skali wodorowej (czyli przyjmując, że masa atomu wodoru wynosi 1) są w większości liczbami całkowitymi. Jego hipotezę odrzucono (nie udało się oczywiście wydzielić wodoru z innych pierwiastków), choć po stu latach okazało się jednak, że Prout aż tak bardzo się nie pomylił.
Niektóre obserwacje zdawały się świadczyć o tym, że atomy mają jakąś wewnętrzną strukturę. Odkrycie i zastosowanie zjawisk związanych z przepływem prądu w roztworach (ogniwa galwaniczne oraz elektroliza) dowodziły, że atomy mogą przyłączać i tracić ładunki elektryczne. Widma atomowe powstające w wyniku emisji światła przez związki chemiczne ogrzewane w płomieniu palnika były charakterystyczne dla każdego pierwiastka.
Różnice w układzie linii widmowych również sugerowały istnienie wewnętrznej struktury atomów (co nie powinno być obserwowane, gdyby atomy były jednolicie wypełnione materią). Także układ okresowy pierwiastków stał się argumentem na rzecz istnienia wewnętrznej struktury atomów. Regularne powtarzanie się pierwiastków o bardzo podobnych właściwościach najłatwiej było wytłumaczyć właśnie podobieństwem budowy ich atomów.
Przełom w nauce o strukturze atomu zapoczątkowały badania wyładowań elektrycznych w rozrzedzonych gazach. Zaobserwowano nieznane dotąd promieniowanie wysyłane przez elektrodę ujemną (katodę), zwane promieniowaniem katodowym (3).
Ulegało ono odchyleniu w polu elektrycznym i magnetycznym, stanowiło zatem strumień ujemnie naładowanych cząstek. Stosunek ich ładunku do masy wyznaczył w roku 1897 Joseph John Thomson. W przypadku każdego gazu wypełniającego rurę do wyładowań był on identyczny, czyli poruszające się cząstki stanowiły składnik każdego atomu.
Nazwano je elektronami (4). Wartości samej masy i ładunku elektronów określił w roku 1909 Robert Millikan. Ładunek był identyczny z jednostkowym ładunkiem jonów (wyznaczonym podczas elektrolizy), natomiast masa okazała się znikomo mała - równa ok. 1/1840 masy najlżejszego z atomów.
Odkrycie promieniowania rentgenowskiego (Wilhelm Conrad Röntgen, 1895), powstającego w wyniku hamowania rozpędzonego strumienia elektronów, stało się sensacją w świecie nauki końca XIX wieku. Liczni badacze przystąpili do eksperymentów, czego efektem było m.in. odkrycie promieni wydzielanych przez uran i jego związki (Antoine Henri Becquerel, 1896). To osiągnięcie zainteresowało skromną doktorantkę z Polski, która wraz z mężem stwierdziła, że również tor wysyła promienie, a w rudzie uranowej odkryła dwa pierwiastki o podobnych własnościach (polon i rad, 1898).
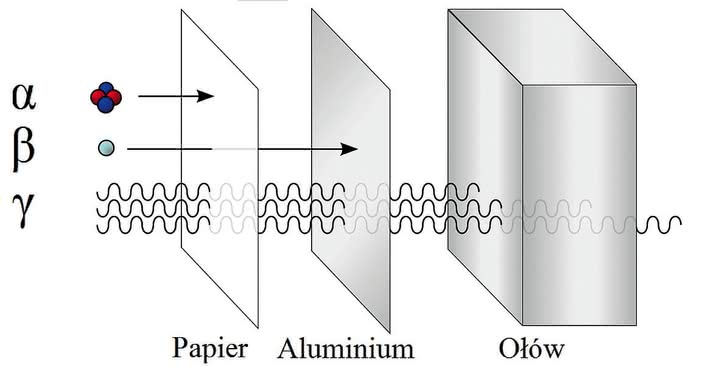
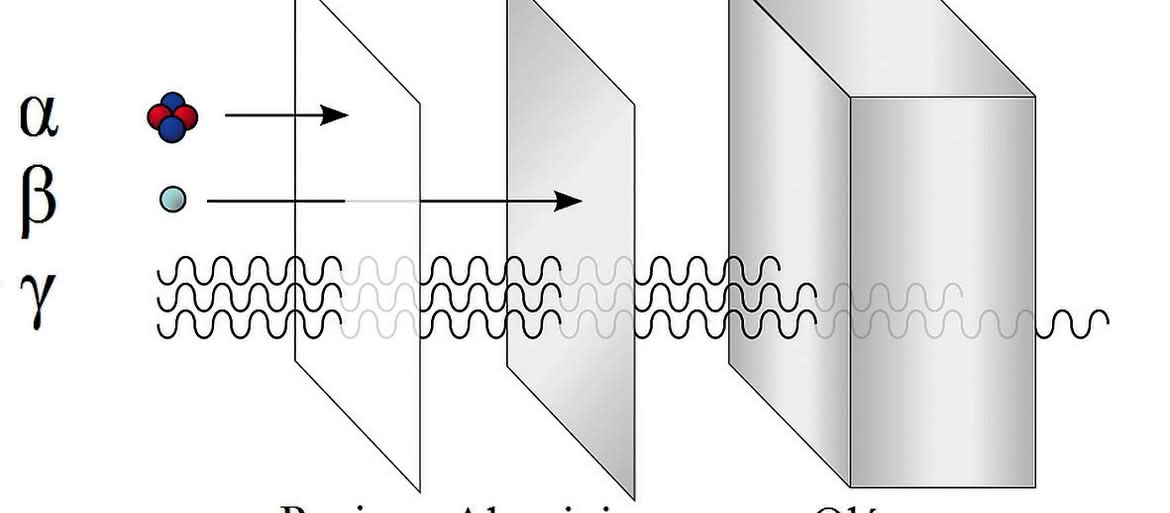
Opis ciężkiej pracy Marii i Piotra Curie nad wydzieleniem dostrzegalnych ilości radu to znana wszystkim historia. Badania emitowanego promieniowania pozwoliły stwierdzić, że są to zjonizowane atomy helu (promienie α), elektrony (β) oraz promieniowanie rentgenowskie (γ) (5). Wyniki doświadczeń obaliły jeden z dogmatów teorii atomistycznej - atom rozpadał się na części, a w efekcie powstawały nowe pierwiastki. Gmachy fizyki i chemii zachwiały się w posadach.
Może to ciasto z rodzynkami?
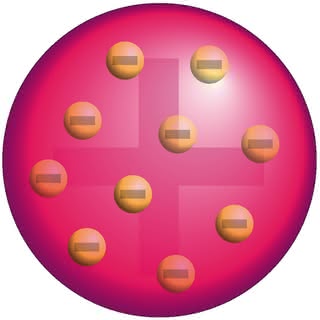
Atom zawiera ujemnie naładowane elektrony, natomiast jako całość jest elektrycznie obojętny. Musi zatem posiadać również ładunek dodatni, równoważący ładunek elektronów. W roku 1902 jeden z największych fizyków tej epoki, lord Kelvin (William Thompson), zaproponował pierwszy model budowy atomu. Według niego centralną część układu stanowiły ładunki ujemne, natomiast ładunki dodatnie poruszały się wokół nich.
Opierając się na modelu Kelvina, J.J. Thompson (odkrywca elektronu) dwa lata później opracował własną koncepcję. Wewnątrz kulistej przestrzeni poruszały się elektrony symetrycznie rozmieszczone wokół środka układu. Ponieważ masa elektronów stanowi drobny ułamek masy całego atomu, kulista przestrzeń powinna być wypełniona materią o ładunku dodatnim. Całość przypominała drożdżowe ciasto nadziewane rodzynkami (model powstał w Anglii, był to zatem pudding) (6).
A może układ planetarny?
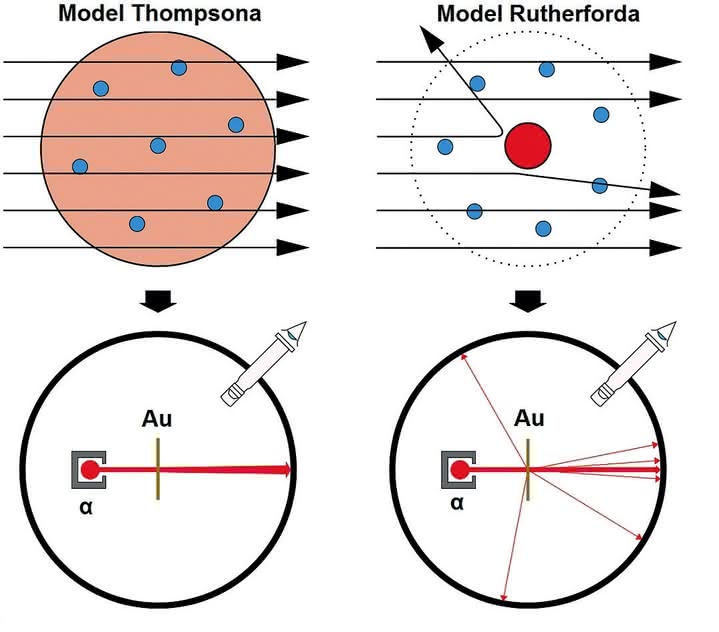
Prawdziwość modelu Thomsona dość szybko została zweryfikowana. W roku 1909 studenci Ernsta Rutherforda (odkrywca promieni α i β), Hans Geiger i Ernst Marsden, przeprowadzili doświadczenie polegające na bombardowaniu bardzo cienkiej folii ze złota (grubości zaledwie kilkuset warstw atomów) cząstkami α (7). Wyniki były zdumiewające.
Większość cząstek przechodziła przez folię bez żadnej zmiany toru ich ruchu. Oznaczało to, że atom nie jest, jak sadził Thompson, jednolicie wypełniony materią, lecz stanowi praktycznie pustkę (inaczej cząstki α powinny zostać zatrzymane w materiale folii). Jeszcze bardziej zadziwiający był fakt, że tory nielicznych cząstek odchyliły się o duży kąt, a niektóre z nich zostały wręcz odrzucone wstecz.
Cząstka a ma masę ponad 7300 razy większą od elektronu i porusza się z prędkością wynoszącą ok. 1/4 prędkości światła, zderzenie z elektronem nie mogło mieć wpływu na zauważony efekt (z tych samych powodów, dla których zderzenie samochodu z piłką tenisową nie zmienia kierunku ruchu pojazdu).
Jedynym wytłumaczeniem wszystkich obserwacji było istnienie w centrum atomu nieomal punktowego ładunku dodatniego i to o dużej wartości. Jego rozmiary oszacowano na 10-12÷10-13 cm, czyli 10-100 tysięcy razy mniej niż wynosi średnica atomu (rzędu 10-8 cm, ją z kolei wyznaczono analizując zderzenia cząsteczek w gazach) (8).
Opierając się na wynikach eksperymentu, Rutherford opracował nowy model budowy atomu. W środku znajdował się ładunek dodatni, skupiony w tzw. jądrze, a po orbitach wokół niego (których średnice odpowiadały rozmiarom atomu) krążyły elektrony. Ze względu na znikomą masę elektronów, praktycznie całą masę atomu stanowiło jądro. Po prostu Układ Słoneczny w miniaturze.