Te, które tworzą sole - Chlor raz jeszcze

W przemyśle chlor wytwarza się zwykle przez elektrolizę solanki, ale w naszym przypadku byłby to sposób bardzo mało wydajny. W grę wchodzi więc metoda chemiczna, polegająca na utlenianiu chlorowodoru. Najpierw zapoznaj się jednak z "Krótkim BHP pracy z chlorem", który znajdziesz na s. 74.
W postaci wolnej
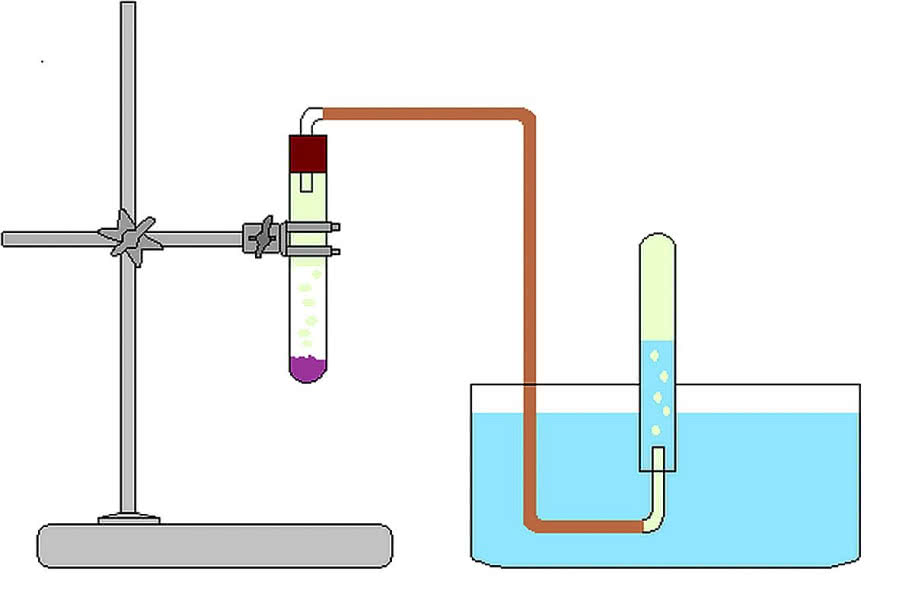
Dysponując lepszym wyposażeniem warsztatowym, wykonaj prosty zestaw widoczny na rysunku poniżej. Chlor zbieraj do dużej probówki w naczyniu wypełnionym ciepłą solanką (w ten sposób ograniczysz jego rozpuszczanie się w wodzie). Do reakcji użyj kwasu solnego oraz nadmanganianu potasu KMnO4 (chlor wywiązuje się już na zimno) lub też dichromianu(VI) potasu K2Cr2O7 (musisz ogrzewać probówkę) (1). Po napełnieniu probówki gazem, załóż na rękę ochronną rękawiczkę, zakryj wylot probówki palcem i wyjmij ją z naczynia. Odwróć probówkę wylotem do góry (chlor ma większą gęstość niż powietrze i gromadzi się na dnie) i zakorkuj ją. Możesz ostrożnie chlor powąchać (o tym, jak wącha chemik, przeczytasz w poprzednim odcinku) - zapach będzie podobny do tego, który wyczujesz, stosując wybielacz, płyn do dezynfekcji czy też będąc na pływalni.
Jeszcze prostszy zestaw wymaga tylko kolby, na której dno wsypiesz niewielką ilość kryształków KMnO4. Po wlaniu kwasu solnego rozpoczyna się burzliwa reakcja, a zawartość naczynia przyjmuje zielonkawe zabarwienie, pochodzące od wydzielonego chloru:
Otrzymany chlor stopniowo wypycha powietrze z kolby, a po reakcji możesz go "przelać" do innego naczynia (2).
Teraz pora na eksperyment.
Koniec miedzianego drutu skręć w spiralę i umocuj ją do korka pasującego do naczynia z chlorem. Spiralę rozgrzej w płomieniu palnika i szybko włóż do pojemnika z chlorem. Miedź rozgrzewa się, można nawet powiedzieć, że pali, a naczynie wypełniają brunatne dymy:
Chlorek miedzi(II) nie ma właściwej krystalicznym solom tego metalu barwy niebieskiej lub zielonej, ponieważ jest bezwodny (3).
W służbie bieli
Zanim został uznany za pierwiastek, chlor już zdobył praktyczne zastosowanie. Sam odkrywca zauważył, że niszczy barwniki, co od razu wykorzystano do wybielania tkanin.
Łatwo się o tym przekonasz. Dwie zlewki napełnij chlorem, do jednej wlej 5-10 cm3 stężonego kwasu siarkowego, a do drugiej pół łyżeczki wody. Naczynia pozostaw szczelnie zamknięte przez godzinę. Do korków przymocuj fragment kolorowej bawełnianej tkaniny lub barwny płatek kwiatu. Zamknij kolby korkami, tak aby tkanina lub płatek znajdowały się wewnątrz. W kolbie z "mokrym" chlorem proces bielenia zachodzi natychmiast, w kolbie z wysuszonym gazem brak oznak reakcji (4). Co ma jednak woda do wybielających właściwości chloru?
Powodem jest fakt, że to nie chlor niszczy barwniki, lecz tlen. Powstaje on w wyniku reakcji chloru z wodą i rozkładu tworzącego się nietrwałego kwasu chlorowego(I) (zwanego podchlorawym):
To właśnie aktywny atomowy tlen działa niszcząco na barwniki, a rolą chloru jest wytworzenie go w środowisku reakcji (czyli in situ, co z łaciny znaczy "na miejscu"). Zrozumiały staje się więc fakt, że suchy chlor nie działa wybielająco (teraz już wiesz, dlaczego w poprzednim odcinku polecałem zwilżyć papierek lakmusowy podczas wykrywania choru).
Posługiwanie się gazowym chlorem nie jest wygodne ani bezpieczne. Po koniec XVIII wieku francuski chemik Claude Berthollet rozpuścił chlor w roztworze wodorotlenku potasu:
otrzymując silny środek wybielający (podchloryn potasu rozkłada się z wydzieleniem atomowego tlenu analogicznie do kwasu podchlorawego). Od nazwy miejscowości, w której miał laboratorium, wybielacz nazwano "wodą z Javel". Podobnie postąpił inny francuski chemik Antoine Labaraqque, ale użył roztworu wodorotlenku sodu (jego wybielacz to "woda Labaraqque’a"). Jednak jak zwykle zwyciężyła ekonomia. Wodorotlenki sodu i potasu były drogie, więc kosztowne wybielacze nie mogły znaleźć szerszego zastosowania. Szkocki chemik i przemysłowiec Charles Tennant rozpuścił chlor w tanim mleku wapiennym, czyli zawiesinie wodorotlenku wapnia, powszechnie używanym w budownictwie jako składnik zapraw. Podchloryn wapnia stał się dostępnym dla wszystkich środkiem wybielającym i dezynfekcyjnym (patrz ramka: "Ostrożnie z wybielaczem"). Również sam chlor i jego łatwo rozkładające się związki są do dzisiaj powszechnie używane do odkażania wody wodociągowej, neutralizacji ścieków, bielenia tkanin i papieru.
Za i przeciw chlorowi
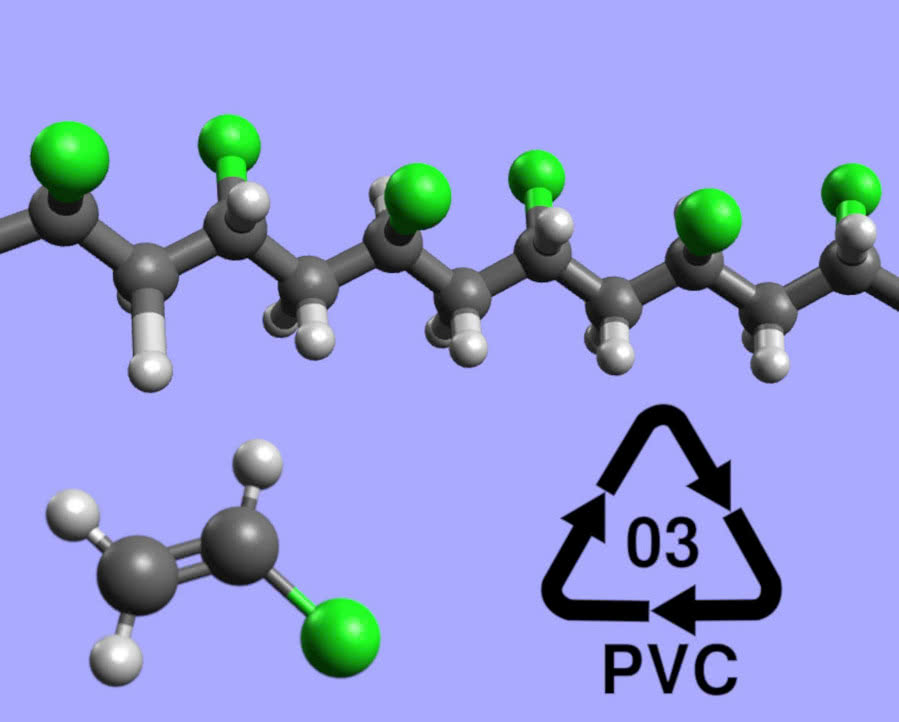
Wolny chlor stosuje się do szeregu syntez chemicznych, głównie produktów organicznych (jak wykryć chlor w związkach organicznych, patrz ramka: "Zielony płomień"). W dużych ilościach produkowany jest polichlorek winylu PVC, tworzywo sztuczne używane do wyrobu m.in. ram okiennych, rur kanalizacyjnych i wodociągowych, sztucznej skóry (5). Z udziałem chloru powstają odporne chemicznie kauczuki chloroprenowe (farby na ich bazie służą do malowania znaków na jezdniach) i żywice epoksydowe. Jego związki są substratami do syntezy tak ważnych produktów, jak metyloceluloza (farmacja, przemysł spożywczy), tworzywa silikonowe (kosmetyki, medycyna, budownictwo) i poliwęglany (szyby, płyty kompaktowe). Osobnym zagadnieniem jest zastosowanie chlorowcopochodnych jako środków ochrony roślin - w tej roli są wprost nie do zastąpienia i nic nie wskazuje na zmniejszenie ich produkcji, zwłaszcza wobec faktu rosnącej liczby ludności Ziemi.
Eksperymenty wykonane z astatem (próbki zawierały miliardowe części grama tego pierwiastka!) udowodniły, że jest to taki mniej aktywny jod. Z wodorem tworzy HAt, a z aktywnymi metalami astatki zawierające jon At–. Potwierdzono również istnienie anionów tlenowych kwasów astatu. Prawdopodobnie będzie zachowywał się również jako półmetal i tworzył jony dodatnie (u leżącego wyżej jodu stwierdzono występowanie np. octanu o wzorze I(CH3COO)3). Jeśli uda się kiedyś wykonać eksperymenty z tennessine, to u tego pierwiastka charakter metaliczny wystąpi jeszcze wyraźniej.
Czas na rzetelne rozważanie wszystkich "za" i "przeciw" w stosunku do chloru. Złą sławę rozpoczęło użycie go w roli gazu bojowego na frontach I wojny światowej, choć wkrótce został wyparty przez "skuteczniejsze" środki. Pamiętajmy jednak, że to ludzie decydują o zastosowaniu danej substancji, więc to pod ich adresem - a nie chloru - należy kierować zarzuty.
• Pracujesz na zewnątrz lub pod sprawnym wyciągiem.
• Otrzymujesz go w bardzo małych ilościach.
• Unikasz wdychania.
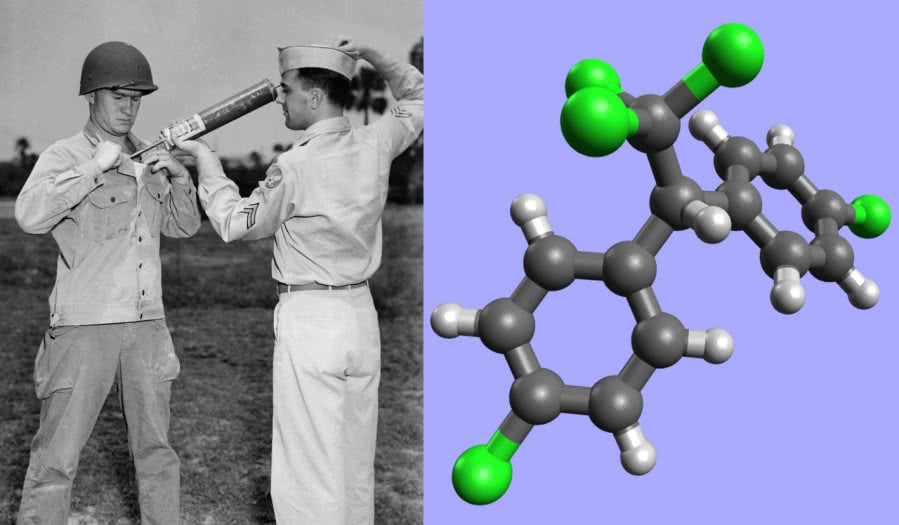
W ubiegłym wieku wielką karierę, potem spektakularny upadek, a w końcu rehabilitację zanotowała substancja oznaczana skrótem DDT. Znany od XIX wieku związek okazał się w latach 40. znakomitym środkiem owadobójczym. W krótkim czasie po jego zastosowaniu praktycznie uporano się z plagą malarii (jedną z przyczyn używania tego środka była konieczność ochrony żołnierzy walczących podczas II wojny światowej i następnych konfliktów zbrojnych w krajach tropikalnych), ocalając życie milionów ludzi (6).
Sukces DDT był tak oczywisty, że odkrycie tego insektycydu zaliczono do największych osiągnięć nauki, a jego autora uhonorowano Nagrodą Nobla w dziedzinie medycyny (Paul Müller, 1948). Jednakże wkrótce pojawiły się głosy krytyczne, oskarżające nowy środek o powodowanie szkód w środowisku i zagrożenie dla ludzkiego zdrowia. Związek, gromadząc się w tkankach organizmów żywych (drobnoustrojom nie "smakuje" wiązanie pomiędzy chlorem i węglem, wobec czego chlorowcopochodne są z trudem rozkładane), miał prowadzić do szeregu niekorzystnych zmian: nowotworów, mutacji genetycznych i obniżenia płodności. Przypisywano mu także wyginięcie wielu gatunków. W ciągu krótkiego czasu zaprzestano więc jego użycia. Na skutki nie trzeba było długo czekać - malaria znowu zaczęła zbierać śmiertelne żniwo. Do dzisiaj zresztą jest ona poważnym problemem, a - jak na ironię - przeciwko DDT najczęściej protestują ludzie w krajach Europy, gdzie ta choroba nie występuje.
Chlor w związkach organicznych wykryjesz metodą płomieniową. Potrzebny ci będzie miedziany drucik i palnik. Drucik wyżarz w płomieniu palnika, aż płomień przestanie się zabarwiać. Odrobinę substancji umieść na końcu drucika i wprowadź do płomienia. Zielona barwa potwierdzi obecność chloru w badanym związku. Podczas rozkładu związku organicznego w wysokiej temperaturze atomy chloru łączą się z miedzią, a obserwowana barwa płomienia pochodzi od chlorku miedzi (podobny kolor wystąpi, gdy związek zawiera atomy bromu lub jodu) (7).
Liczne badania nie potwierdziły stawianych temu środkowi zarzutów, o ile jest stosowany w zalecanych dawkach i w odpowiedni sposób (a to dotyczy wszystkich związków chemicznych). Obecnie DDT zaliczane jest do najmniej toksycznych preparatów używanych przeciwko owadom, co potwierdziło oświadczenie Światowej Organizacji Zdrowia WHO z 2006 r.
Należy także pamiętać o zastosowaniu chloru do dezynfekcji wody pitnej. Mimo że w silnie zanieczyszczonej wodzie mogą powstawać szkodliwe chlorowcopochodne, to nie można zrezygnować z jego użycia ze względu na zapobieganie szerzeniu się epidemii chorób przewodu pokarmowego. Nie widać również chęci wyrzeczenia się używania domowych środków dezynfekcyjnych oraz wybielanego papieru i tkanin.
Co więc zrobić z chlorem? Chemicy mogą znaleźć zamienniki dla niektórych przemysłowych zastosowań chloru, ale należy liczyć się ze zwiększonymi kosztami końcowych wyrobów (za które zapłacą oczywiście konsumenci) i pogorszeniem ich własności użytkowych. Należy również brać pod uwagę fakt ocalenia życia milionów ludzi przed malarią i chorobami przenoszącymi się przez brudną wodę oraz ofiary, które kosztowała decyzja o zaprzestaniu stosowania DDT. Współczesny świat powiązany jest skomplikowaną siecią zależności i podjęcie wydawałoby się słusznej, na pierwszy rzut oka, decyzji może skutkować nieoczekiwanymi konsekwencjami. Dlatego zanim zostaną wdrożone działania, należy z uwagą wysłuchać fachowców i zastosować się do ich rad. W przypadku chloru są nimi właśnie chemicy.
Stosując chlorowy wybielacz lub środek dezynfekcyjny, należy zachować ostrożność i nie używać go w środowisku kwaśnym. Ponieważ w preparacie zawsze obecne są chlorki (np. z rozkładu podchlorynu), po zakwaszeniu podchloryn utlenia je do wolnego chloru, sam również redukując się do tego gazu.
A chloru lepiej nie wdychać.
Krzysztof Orliński