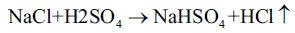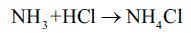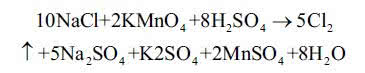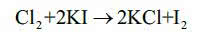Te, które tworzą sole - Chlor

Chlor ma zdecydowanie złą prasę. Obok ołowiu i rtęci jest od dawna na celowniku rozmaitych organizacji żądających ograniczenia lub wręcz zakazu jego stosowania. Gaz bojowy podczas I wojny światowej, ponurej sławy środek owadobójczy DDT, freony czy chlorowane tworzywa sztuczne - lista zarzutów jest długa. Nie powinniśmy się jednak kierować medialnymi sensacjami, lecz rzetelną wiedzą, a w przypadku chloru to przecież właśnie chemicy są najbardziej kompetentni.
Tlenek czy pierwiastek?
W 1774 r. szwedzki aptekarz i chemik Karl Scheele, działając stężonym kwasem solnym na minerał braunsztyn (dwutlenek manganu), odkrył zielonożółty gaz o duszącej woni:
Antoine Lavoisier, twórca nowoczesnej chemii, uważał, że każdy kwas musi zawierać tlen, zatem i kwas solny również. Wobec tego otrzymany gaz jest tlenkiem jakiegoś niemetalu. Hipotetycznemu pierwiastkowi nadano nazwę Murium (z łac. murex = solanka). Jednak próby stwierdzenia obecności tlenu w chlorze nie dały rezultatu przez prawie czterdzieści następnych lat.
Dopiero odkrycie podobnego do chloru jodu, a następnie bromu nakierowało chemików na właściwy trop. Pierwiastkowego charakteru chloru dowiódł inny sławny chemik tamtych czasów - sir Humphry Davy (1). On też nadał mu stosowaną do dzisiaj nazwę, która pochodzi od greckiego słowa chloros, czyli zielonożółty (ten sam źródłosłów ma chlorofil, zielony barwnik roślinny) (2).
W polskiej nomenklaturze chemicznej funkcjonowało przez pewien czas określenie soliród, co jest dosłownym tłumaczeniem pojęcia halogen, ale później przyjął się chlor. Chemicy w początkach XIX wieku musieli zatem pogodzić się z faktem istnienia dwóch rodzin kwasów - tlenowych i beztlenowych.
Wszechobecny
Ze względu na swoją reaktywność chlor nie występuje w przyrodzie w stanie wolnym (pozostałe fluorowce również nie). Jedyna naturalna postać chloru to jony chlorkowe Cl-, zarówno jako składnik minerałów, jak i soli rozpuszczonych w wodzie. Najczęściej występującym minerałem chloru jest halit, czyli chlorek sodu NaCl, który w domu spotkasz w postaci soli kuchennej. Gospodarczo ważny jest również sylwin KCl, służący do produkcji nawozów potasowych.
Chlorki są zwykle dość dobrze rozpuszczalne w wodzie, nie powinna więc dziwić duża ich zawartość w morzach i oceanach (chlor to prawie 2% masy wszystkich wód wszechoceanu). Pokłady chlorków sodu, potasu i magnezu są skutkiem wysychania pradawnych mórz (złoża na Kujawach i w Wielkopolsce mają ok. 250 mln lat, a w Wieliczce kilkanaście mln lat) (3).
Zawartość komórek organizmów żywych jest odzwierciedleniem środowiska, w którym wyewoluowały, jony chlorkowe pełnią więc również ważne role biologiczne. Anion chlorkowy utrzymuje prawidłowe ciśnienie osmotyczne płynów ustrojowych i wpływa na działanie enzymów. Około 2% roztwór kwasu solnego w naszych żołądkach niszczy drobnoustroje dostające się wraz z pokarmem oraz umożliwia działanie peptydaz, enzymów trawiących białka.
Zielonożółty agresor
Chlor jest bardzo aktywnym pierwiastkiem, niewiele pod tym względem ustępującym fluorowi. Energicznie reaguje z większością metali, choć czasem potrzebne jest wstępne ogrzanie reagentów. Wpływowi chloru ulegają także niemetale - np. siarka czy fosfor palą się w jego atmosferze. Reakcja z wodorem zachodzi wybuchowo w świetle słonecznym, lecz w ciemności mieszanina obu pierwiastków może być przechowywana bezpiecznie. Chlor reaguje także z węglowodorami, a ich chlorowe pochodne są ważnymi substratami do dalszych syntez.
Chlor rozpuszcza się w wodzie, a otrzymany roztwór - woda chlorowa - stosuje się jako utleniacz, środek dezynfekujący i odczynnik chemiczny. Oprócz chlorków zawierających anion Cl- i związków niejonowych, w których chlor ma wartościowość I, istnieją również tlenowe kwasy chloru i ich sole, w których przybiera on nieparzyste wartościowości od I aż do VII (maksymalna dla grupy 17).
Chlor ma wiele zastosowań w przemyśle chemicznym, zatem produkowany jest w dużych ilościach (ok. 65 mln ton w roku 2016). Podstawową metodę stanowi elektroliza roztworu NaCl. W jej wyniku otrzymuje się aż trzy ważne produkty: chlor, wodór oraz wodorotlenek sodu. Elektroliza stopionego NaCl daje natomiast chlor oraz sód, na który również jest popyt. Najważniejszy przemysłowy związek chloru - chlorowodór - ma także wiele zastosowań, czy to w postaci gazowej, czy też roztworu (kwas solny).
Wytwarzany jest w wyniku spalania wodoru w chlorze lub też jako produkt uboczny reakcji z udziałem chloru. Chemiczne metody wytwarzania chloru podobne są do sposobu otrzymania go przez odkrywcę i polegają na utlenieniu chlorowodoru. Stosuje się je w laboratoriach chemicznych, a w przemyśle za ich pomocą zwykle utylizuje się nadmiar HCl.
Cl–, czy to ty?
Podstawową próbą analityczną pozwalającą wykryć anion chlorkowy jest tworzenie osadu z roztworem azotanu(V) srebra AgNO3. Pamiętaj o użyciu wody destylowanej (inaczej wykryjesz jon chlorkowy w wodzie z kranu) i zabezpieczeniu otoczenia oraz skóry rąk.
Próby wykonuj na tacy i w ochronnych rękawiczkach, a unikniesz ciemnych plam, które z dłoni zejdą po kilku dniach, ale z odzieży już nie.
Do roztworu zawierającego rozpuszczalny w wodzie chlorek, np. NaCl, dodaj roztwór AgNO3. Od razu wytrąci się biały, serowaty osad AgCl. Zlej ciecz znad osadu i podziel go na dwie części. Jedną pozostaw na świetle, do drugiej dodaj rozcieńczony roztwór amoniaku NH3aq, zamieszaj, a po rozpuszczeniu osadu – wlej roztwór kwasu azotowego(V) HNO3.
Ponieważ wiele soli srebra jest trudno rozpuszczalnych i ma białą barwę, nie wystarczy samo powstawanie osadu o takim właśnie kolorze. Ciemnienie osadu na świetle (tak zachowała się pierwsza porcja) spowodowane jest jego rozkładem z wydzieleniem wolnego metalu w postaci bardzo rozdrobnionej.
Podobnie zachowują się osady tworzone przez bromki i jodki, mają one jednak żółtawe zabarwienia. Osad rozpuszcza się w roztworze amoniaku (to odróżnia go od AgBr i AgI) i ponownie ulega wytrąceniu pod wpływem dodatku mocnego kwasu (pozostawiony na świetle oczywiście wkrótce ściemnieje). Dopiero tak przeprowadzona próba upoważni cię do stwierdzenia obecności jonów chlorkowych w badanym roztworze (4).
Inny sposób wykrycia jonów chlorkowych polega na reakcji stężonego roztworu kwasu siarkowego(VI) H2SO4 z chlorkami w postaci stałej. Do próbówki wsyp nieco NaCl, a następnie wlej kilka kropel stężonego roztworu H2SO4:
Jeśli już koniecznie "musisz" w ten sposób stwierdzić obecność chlorowodoru, nie nachylaj się nad probówką i nie zaczerpuj powietrza "pełną piersią", lecz wachlującym ruchem dłoni nakieruj wydzielający się gaz w swoją stronę i pozwól woni samej dotrzeć do nosa (takie postępowanie charakteryzuje doświadczonego chemika, który już przekonał się, czym grozi niewłaściwe wąchanie chemikaliów).
Zamiast nosa lepiej u wylotu probówki umieść zwilżony wodą papierek wskaźnikowy (stanie się czerwony pod wpływem HCl) lub bagietkę szklaną, której koniec uprzednio zanurzyłeś w stężonym roztworze amoniaku. Pojawiające się białe dymy chlorku amonu NH4Cl pozwolą stwierdzić obecność HCl w otoczeniu, a równocześnie jonów chlorkowych w badanej próbce (5):
Jeszcze inny sposób polega na utlenieniu chlorków do wolnego chloru i wykryciu cząsteczek Cl2. Tym razem do badanego roztworu w probówce lub soli w postaci stałej dodaj roztwór nadmanganianu potasu KMnO4 i zakwaś środowisko reakcji przy pomocy rozcieńczonego roztworu kwasu siarkowego(VI) H2SO4. Zaobserwujesz odbarwienie ciemnofioletowego roztworu (to jeszcze nie dowód obecności chlorków - zakwaszony roztwór KMnO4 odbarwi się w obecności wielu substancji o charakterze redukującym) i wydzielanie gazu o charakterystycznej woni (czasem trzeba podgrzać probówkę):
Obecność chloru możesz stwierdzić powonieniem (nadal obowiązują zalecenia z poprzedniej próby). Zapach z pewnością wyda ci się znajomy - tak pachną płyny dezynfekcyjne, wybielacze czy też powietrze na pływalni. Zamiast nosa warto jednak wykorzystać utleniające właściwości Cl2. Nad probówką umieść zwilżony wodą (koniecznie!) papierek lakmusowy. Odbarwienie papierka świadczy o wydzielaniu wolnego chloru z naczynia reakcyjnego.
I jeszcze jeden sposób wykrycia chloru, który wymaga sporządzenia własnego papierka. Potrzebny będzie jodek potasu KI i skrobia, czyli zwykła mąka ziemniaczana. Łyżeczkę mąki rozmieszaj w niewielkiej ilości zimnej wody i wlej do ok. 0,5 dm3 wrzątku. Wodę ze skrobią gotuj, aż roztwór stanie się przezroczysty, a potem odstaw garnek do ostygnięcia. Pobierz kilkanaście cm3 roztworu skrobi i rozpuść w nim szczyptę jodku potasu. Do tak otrzymanego roztworu zanurz paski bibuły filtracyjnej i wysusz je.
Twoje papierki jodoskrobiowe są gotowe do użycia, przechowuj je w szczelnie zamkniętym pudełku. Gdy umieścisz zwilżony wodą papierek nad probówką, z której wydziela się chlor, zauważysz ściemnienie bibuły. To zielonożółty gaz, jako silniejszy niż jod utleniacz, wyparł ten ostatni z jego soli:
Wykonanie wykresu na podstawie podanych w poprzednim odcinku temperatur topnienia i wrzenia ułatwi ich oszacowanie dla astatu i tennessine. Dla czterech pierwszych fluorowców punkty pomiarowe układają się prawie na liniach prostych. Przedłużenie linii pozwoli stwierdzić, że astat topi się w temperaturze ok. 220°C, a wrze w pobliżu 320°C. Dla najcięższego fluorowca będzie to odpowiednio 330 i 430°C. W podręcznikach
znajdziesz dane dla astatu: temperatura wrzenia prawie się zgadza, natomiast według ich autorów astat topi się w temperaturze ok. 300°C (widocznie dedukowali w inny sposób). Nie zrażaj się różnicami - szacowanie własności fizycznych nie jest proste.
Krzysztof Orliński