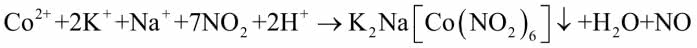Wzorzec metaliczności, część 2 - najważniejsze

Sód i potas to najważniejsze pierwiastki grupy 1 i jedne z najważniejszych zarówno w przemyśle, jak i świecie ożywionym. Powierzchniowa warstwa Ziemi zawiera aż 2,8% sodu i 2,5% potasu, co daje im 6 i 7 miejsca na liście rozpowszechnienia pierwiastków.
Długa historia
Początek znajomości ludzi ze związkami sodu i potasu ginie w mrokach prehistorii. Od zawsze potrzebna była sól, czyli chlorek sodu NaCl, jako niezbędny składnik pożywienia i konserwant (1). Natron to występujący naturalnie węglan sodu Na2CO3, który w starożytnym Egipcie służył do wytopu szkła, prania oraz osuszania zwłok podczas mumifikacji.
Przez zalanie popiołu roślinnego wodą i odparowanie roztworu otrzymywano węglan potasu K2CO3, zwany przez Arabów al-kali, a przez Europejczyków potażem (z ang. potash - popiół z garnka).Ten związek również był używany jako składnik szkła oraz element wykorzystywany do wyrobu środków czystości.
Alchemicy potraktowali natron i potaż mlekiem wapiennym (roztwór wodorotlenku wapnia), otrzymując związki o silniejszym odczynie zasadowym, czyli wodorotlenki sodu i potasu. Od tej pory NaOH i KOH zwano alkaliami żrącymi, a węglany tych metali - alkaliami łagodnymi.
W XVIII wieku zaczęto wyraźnie rozróżniać związki sodu i potasu, dotąd uważane zazwyczaj za tę samą substancję. W końcu stulecia Lavoisier umieścił alkalia na liście pierwiastków, ponieważ nie potrafiono ich jeszcze rozłożyć na składniki. Dokonał tego dopiero jeden z najsławniejszych chemików owego czasu - sir Humphry Davy w roku 1807 (2). Przez elektrolizę wilgotnych wodorotlenków wydzielił z nich metale, którym nadał łacińskie nazwy Natrium i Kalium (3, 4). W poszczególnych językach ich nazwy wywodzą się od imion łacińskich lub są zbliżone do polskiego sodu i potasu.
Wszędobylskie
Nie ma miejsc na Ziemi, w których nie byłyby obecne związki tych pierwiastków. Tworzą one liczne minerały wchodzące w skład skał. Z nich są wymywane przez wody opadowe i wędrują do mórz. Gleba i rośliny zatrzymują jednak sole potasu, więc woda morska zawiera dużo związków sodu i tylko niewiele potasu. W wyniku procesów geologicznych dochodzi do wysychania zbiorników morskich, w efekcie czego powstają osady soli rozpuszczonych w wodzie. W ten sposób utworzyły się pokłady soli kamiennej NaCl, którym towarzyszą złoża soli potasowych (zwykle KCl).
Świat roślinny preferuje jony potasu, które są mu niezbędne do prawidłowego wzrostu i rozwoju (potas to jeden z głównych, obok azotu i fosforu, składników nawozów sztucznych). W płynach ustrojowych zwierząt jest więcej jonów sodu, ale w przypadkach obu światów najistotniejszy pozostaje wzajemny stosunek obu pierwiastków - jego zachwianie prowadzi do zaburzeń. Sód i potas aktywują wiele enzymów, utrzymują nawodnienie komórek, prawidłowe działanie błon komórkowych i biorą udział w przewodzeniu impulsów nerwowych.
Izotop potas-40 jest radioaktywny, a jego okres połowicznego zaniku wynosi ponad miliard lat. Promieniotwórcza odmiana stanowi zaledwie 0,01% całego potasu, ale zawartość tego pierwiastka jest tak duża, że K-40 należy do izotopów najbardziej wpływających na środowisko naszej planety. Jedną z dróg rozpadu jest tworzenie argonu i to dzięki promieniotwórczości potasu ziemska atmosfera zawiera prawie 1% tego gazu szlachetnego.
Przez wyznaczenie zawartości argonu powstałego z potasu w skałach możliwe staje się określenie wieku ich powstania. K-40 to również jedno z głównych źródeł ciepła geotermicznego Ziemi oraz promieniowania tła. To ostatnie jest stałym czynnikiem środowiskowym wpływającym na częstość pojawiania się mutacji i przebieg ewolucji. Potas-40 to obok węgla-14 również główne źródło rozpadów promieniotwórczych zachodzących w nas samych. Szacuje się, że w ciele osoby ważącej 70 kg w ciągu sekundy rozpadają się ponad 4 tysiące atomów potasu i ok. 3 tysięcy atomów węgla. Jak jednak widać, mechanizmy naprawcze naszych komórek działają sprawnie i wewnętrzna promieniotwórczość nie ma ujemnego wpływu na zdrowie.
Związki sodu i potasu są szeroko stosowane w przemyśle. Jeśli potrzebna jest jakaś sól i nie chodzi o konkretny kation, to zapewne będzie to związek sodu lub potasu (są tanie, łatwe do uzyskania i rozpuszczalne w wodzie). Sól kamienna wydobywana z pokładów lub otrzymywana z wody morskiej stanowi surowiec do produkcji związków sodu (podstawowe to NaOH i Na2CO3), natomiast związki potasu otrzymuje się z KCl (głównie są to nawozy potasowe).
Metaliczny sód i potas wytwarza się przez elektrolizę stopionych chlorków lub wodorotlenków. Gdy tylko warunki techniczne pozwalają, używany jest tańszy sód. Stopiony sód lub mieszanina sodu z potasem to czynnik chłodzący, np. w reaktorach jądrowych. Sam sód używany jest jako reduktor podczas syntezy związków organicznych i katalizator polimeryzacji tworzyw sztucznych, np. butadienu stosowanego do wyrobu opon.
Barwne płomienie
Litowce łatwo ulegają wzbudzeniu pod wpływem wysokiej temperatury i emitują światło widzialne. W przypadku litu (patrz poprzedni odcinek) ma ono barwę karminową. Kolor światła jest ważnym wskaźnikiem diagnostycznym, umożliwiającym stwierdzenie obecności związków danego litowca w próbce.
Zestaw do badań, które teraz nastąpią, jest bardzo prosty: palnik gazowy, drucik żelazny (w laboratoriach stosuje się druciki z platyny) oraz kwas solny do oczyszczenia powierzchni drucika.
Zanurz koniec drucika w roztworze kwasu i umieść go w płomieniu. Po chwili przestanie się on barwić, co oznacza, że powierzchnia została oczyszczona. Dotknij drucikiem próbki związku - tak, aby przykleił się kryształek (możesz zwilżyć drucik wodą destylowaną) - i umieść próbkę w płomieniu.
W przypadku sodu zauważysz intensywnie żółtą barwę (identyczny kolor powstaje, gdy nieco osolonej wody pryśnie z garnka na palnik podczas gotowania potraw) (5).
Żółta linia widmowa sodu ma długość fali ok. 589 nm (ściślej: są to dwie linie położone bardzo blisko siebie), a stosuje się ją do kalibrowania urządzeń optycznych i wyznaczania wartości różnych wielkości fizycznych, np. współczynnika załamania. Wzbudzenie atomów sodu wykorzystywane jest do barwienia ogni sztucznych oraz w lampach sodowych używanych do oświetlania dróg (pobierają mało energii elektrycznej, ale ich światło nie jest przyjemne dla oka) (6).
Próba płomieniowa dla sodu jest tak czuła, że nawet inne związki (formalnie go niezawierające) w trakcie spalania dają żółty błysk, pochodzący od zanieczyszczeń tym pierwiastkiem. Z takim właśnie problemem spotkasz się podczas wykonania próby dla potasu. Różowofioletowa barwa płomienia (7) może zostać zamaskowana przez żółty kolor pochodzący od sodu.
W laboratoriach stosuje się niebieskie szkło kobaltowe, które pochłania żółty fragment widma i umożliwia zaobserwowanie barwy światła wzbudzonych atomów potasu. W twoim przypadku wystarczy płaska butelka wypełniona wodą zabarwioną na niebiesko (np. przez indygo, niebieski atrament czy fiolet metylowy ze specyfiku do odkażania ran - pioktaniny).
Raczej nie będziesz miał okazji przeprowadzić prób płomieniowych dla kolejnych litowców, podam więc tylko, że barwy światła emitowanego przez rubid i cez są podobne jak w przypadku potasu, stają się one jednak coraz bardziej zbliżone do fioletu.
Trudna analityka
Sód i potas, w przeciwieństwo do kationów wielu innych metali, nie mogą pochwalić się wyraźnymi próbami analitycznymi, dzięki którym stwierdza się ich obecność. W przypadku sodu jest to praktycznie tylko próba płomieniowa, lecz tak czuła, a żółta barwa płomienia tak charakterystyczna, że potwierdzenie obecności tego pierwiastka nie stanowi problemu. Istnieje kilka trudno rozpuszczalnych związków sodu, ale w swoim laboratorium nie znajdziesz takich "egzotycznych" odczynników, jak octan magnezowo-uranylowy czy antymonian(V) potasu.
Nieco lepiej ma się sprawa w przypadku potasu. O próbie płomieniowej i problemach z nią związanych czytałeś wyżej. Klasyczna analiza opiera się w dużej mierze na tworzeniu osadów, ale rzut oka na tablicę rozpuszczalności pozwala stwierdzić, że właściwie wszystkie proste związki potasu są dobrze rozpuszczalne w wodzie. Wyjątkiem jest chloran(VII) lub - popularniej - nadchloran.
Gdy na sól potasu podziałasz roztworem dobrze rozpuszczalnego nadchloranu sodu, wydzieli się biały osad. Jednak zauważysz go tylko w stężonych roztworach, ponieważ KClO4 jest znacznie bardziej rozpuszczalny niż inne osady stosowane w analizie chemicznej. Dodatek alkoholu etylowego (np. denaturatu) zmniejsza rozpuszczalność i łatwiej wtedy zaobserwować powstawanie osadu.
Trzeba więc sięgnąć po bardziej wyrafinowane odczynniki. Jeden z nich możesz wykonać samodzielnie. Potrzebne będą roztwory chlorku kobaltu(II) CoCl2 i azotanu(III) sodu NaNO2 (inaczej azotyn sodu), które otrzymasz przez rozpuszczenie połowy łyżeczki soli w 50 cm3 wody (możesz zmniejszyć ilości odczynników, ale zachowaj proporcję). Do zestawu dołącz jeszcze 5-10% spożywczy ocet (roztwór kwasu octowego CH3COOH) oraz oczywiście sól potasu.
Do probówki wlej 5 cm3 roztworu soli kobaltu, następnie zakwaś go 1 cm3 octu i dodaj 5 cm3 roztworu azotynu sodu. Zamieszaj całość i szybko wlej do probówki roztwór dowolnej soli potasu. Zawartość zmieni zabarwienie na żółte, a po pewnym czasie zacznie wytrącać się osad soli mieszanej (8):
Zauważ, że podczas reakcji doszło do utlenienia jonu kobaltu(II) przez aniony azotanowe(III). Dopiero kompleksowy związek kobaltu(III) z jonami potasu i sodu jest trudno rozpuszczalny i dzięki temu umożliwia wykrycie kationów K+ w badanym roztworze.
Za miesiąc porównasz swoje szacunki dotyczące fransu z wynikami innych (patrz ramka: Jaki jest frans?), przeczytasz o kolejnych pierwiastkach grupy 1 i poznasz… honorowego litowca.
Krzysztof Orliński
Zobacz także:
Wzorzec metaliczności część 1 - najlżejszy
Roztwarzanie metali