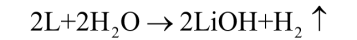Wzorzec metaliczności część 1 - najlżejszy

Czytelnicy, którzy znają właściwości fizyczne litowców, mogą się zdziwić z powodu takiego właśnie stwierdzenia. Substancje, które zazwyczaj topią się w temperaturze nieprzekraczającej 100°C, miękkie tak, że można kroić je nożem i w dodatku błyskawicznie reagujące z tlenem i wodą, to mają być wzorce metali? A co z nich da się zbudować?
Na materiał konstrukcyjny litowce rzeczywiście się nie nadają, ale nie zmienia to faktu, że są one pełnoprawnymi metalami. Powodem rozbieżności jest inne rozumienie tego pojęcia w języku potocznym i naukowym. Nie każdy zatem metal to substancja twarda i trudnotopliwa - przykładem jest chociażby rtęć.
Pierwiastek wagi lekkiej…
Po gazowym wodorze i helu w układzie okresowym pojawia się pierwszy metal - lit. Od jego imienia wzięła nazwę cała rodzina (wodór, choć również leży w grupie 1, znalazł się w niej trochę z konieczności - po prostu trzeba było gdzieś umieścić ten, odbiegający od wszystkich innych, pierwiastek). Wracając do litu, tytuł nie jest przypadkowy dla substancji mającej gęstość 0,54 g/cm3, to tyle co sosnowe drewno.
Kawałek litu pływa po wodzie, ale krótko, ponieważ szybko z nią reaguje. Z obu tych powodów przechowuje się go w skrzepniętej parafinie, gdyż wypływa na powierzchnię nafty służącej do ochrony pozostałych litowców przed wpływem tlenu i wilgoci. Lit topi się w temperaturze ok. 180°C (najwyższej ze wszystkich litowców), ale wrze prawie 1200 stopni wyżej. Tak dużą różnicę rzadko się spotyka. Poza tym jest on srebrzystoszarym metalem, dającym się kroić nożem, ale powierzchnia przekroju szybko ciemnieje (choć wolniej niż w przypadku pozostałych pierwiastków z tej grupy) (1).
W roku 1800 odkryto na szwedzkiej wysepce minerał nazwany petalitem, ale dopiero siedemnaście lat później przystąpiono do zbadania jego składu chemicznego. Zadania podjął się młody Johann August Arfvedson, 25-letni uczeń sławnego Berzeliusa (któremu zawdzięczamy m.in. obecnie używane symbole pierwiastków). Arfvedson stwierdził, że minerał należy do grupy glinokrzemianów, czyli dużej rodziny związków składających się z glinu, krzemu i tlenu, którym towarzyszy metal - zwykle sód, potas czy wapń. Choć analizy wskazywały na obecność w petalicie metalu podobnego do sodu, nie zgadzała się jego masa. Była ona około trzy razy mniejsza niż powinna być, gdyby rzeczywiście sód stanowił składnik minerału (masa atomowa sodu to 23 jednostki, litu - 7 jednostek).
Berzelius, niekwestionowany autorytet tamtych czasów, stwierdził, że odkryto nowy pierwiastek, który nazwał od greckiego słowa lithos, oznaczającego kamień (2). To podkreślało, że choć lit jest podobny do znanych już sodu i potasu, wydzielono go z minerałów, nie zaś z substancji roślinnych i zwierzęcych (jednak i on jest mikroelementem obecnym w szlakach metabolicznych organizmów żywych). Arfvedson znalazł nowy metal również w szeregu innych minerałów, co potwierdziło prawidłowość nazwy. Wydzielenie czystego, metalicznego litu (poprzez elektrolizę jego chlorku) udało się dopiero Robertowi Bunsenowi i Augustusowi Matthiessenowi, w roku 1855. Z nazwiskiem tego pierwszego wiąże się historia odkrycia jeszcze dwóch innych litowców.
Ile litu jest na Ziemi? Całkiem sporo, bo ok. 0,0065% masy powierzchniowej warstwy, co zapewnia mu 26 miejsce na liście zawartości pierwiastków. Choć udział procentowy nie wydaje się szczególnie duży, to litu jest prawie tyle co azotu i więcej niż cynku czy cyny. A we Wszechświecie? Lit powstał krótko po Big Bangu, wraz z wodorem, helem, berylem i borem - nadal jest też produkowany w gwiazdach. Dość łatwo wchodzi jednak w reakcje z protonami, więc kosmos zawiera tylko śladowe ilości litu.
…do ciężkiej pracy
Mimo filigranowej masy lit nie stroni od pracy. Największy tonażowo udział wśród związków tego pierwiastka ma zastosowanie tlenku i węglanu litu jako składników szkła żaroodpornego i powłok na ceramikę. Następnym jest użycie litu do konstrukcji źródeł prądu. To stosunkowo nowe zastosowanie, ale szeroko obecne we współczesnym świecie: począwszy od małych ogniw litowych do zasilania zegarków czy układów elektronicznych komputerów, poprzez ładowalne akumulatory do telefonów komórkowych, laptopów i elektronarzędzi, a skończywszy na akumulatorach w samochodach elektrycznych, np. słynnej Tesli Roadster (3).
Ogniwa litowe są znacznie trwalsze i - ze względu na niską wagę metalu - gromadzą znacznie więcej energii w jednostce masy niż w przypadku konstrukcji opartych na innych pierwiastkach. Sole kwasów tłuszczowych litu (mydła litowe, np. stearynian litu) są cenionym składnikiem smarów pracujących w szerokim zakresie temperatur (w tym i ujemnych). Węglan litu to zaś najstarszy stosowany do dziś specyfik w leczeniu zaburzeń natury psychicznej, stabilizujący pracę układu nerwowego.
Metaliczny lit po raz pierwszy znalazł zastosowanie jako dodatek podnoszący wytrzymałość stopów glinu, ołowiu i magnezu. Lit łatwo łączy się z wodorem, tworząc wodorek. Ponieważ w reakcji z wodą związek ten wydziela wodór, można go stosować jako magazyn wodoru. Podczas ostatniej wojny wodorek litu służył do szybkiego napełniania kamizelek ratunkowych. Izotop lit-6 bombardowany neutronami tworzy tryt (wodór-3), niezbędny do przeprowadzenia syntezy termojądrowej.
Pod wpływem temperatury milionów stopni i ogromnego ciśnienia, tryt łączy się z deuterem (wodór-2), wyzwalając gigantyczne ilości energii. Dotychczas udało się przeprowadzić ten proces tylko w sposób niekontrolowany, podczas wybuchu bomby termonuklearnej (zapalnikiem, dostarczającym neutronów i wytwarzającym odpowiednie warunki reakcji, był wybuch zwykłej bomby atomowej) (4).
Lit na wyciągnięcie ręki
W przeciwieństwie do pozostałych litowców, metaliczny lit jest rzeczywiście na wyciągnięcie ręki. Twoim źródłem będzie ogniwo litowe. Nie bierz tylko akumulatora do zasilania telefonu czy laptopa, ich demontaż jest bowiem niebezpieczny (pamiętaj, aby zużyty sprzęt koniecznie oddać do punktu zbiórki). Do wykonania doświadczeń wystarczy ci ogniwo o oznaczeniu CR2032. Jest ono często stosowane do zasilania niektórych typów kalkulatorów oraz układów płyty głównej komputera.
Ściśnij ogniwo szczypcami (rozpadnie się) i rozłóż fragmenty konstrukcji na tacy. Ogniwo składa się z metalowych części tworzących obudowę, czarnej, sprasowanej warstwy zawierającej dwutlenek manganu MnO2, porowatego separatora nasączonego bezwodnym elektrolitem organicznym oraz izolującego pierścienia z tworzywa sztucznego (5). Lit jest naniesiony na mniejszy fragment obudowy (elektroda ujemna), możesz go przekroić nożem i zobaczyć, że ciemnieje na powietrzu. Końcem żelaznego drucika nabierz nieco miękkiego metalu i wprowadź próbkę do płomienia palnika - zabarwi się on karminowo (6). Kolor jest charakterystyczny także dla związków litu. Podobne zabarwienie zauważysz, wprowadzając do płomienia palnika sole strontu z grupy 2.
Obudowę z resztą metalu wrzuć do zlewki z niewielką ilością wody. W naczyniu zajdzie reakcja roztwarzania litu:
Papierek uniwersalny zanurzony w otrzymanym roztworze barwi się na niebiesko, co świadczy, że wodorotlenek litu to mocna zasada (7). Nie wylewaj roztworu - zaraz wykonasz z nim następne doświadczenia.
Odmieniec
Już odkrywca zauważył podobieństwo litu do pozostałych pierwiastków z grupy 1. Jednak lit zachowuje się trochę odmiennie niż kuzyni o większych masach.
Przelej otrzymany uprzednio roztwór do parowniczki i ostrożnie go odparuj. Po ostygnięciu zalej osad jak najmniejszą ilością 5-10% roztworu kwasu solnego i ponownie odparuj wodę. Otrzymasz chlorek litu LiCl.
Porcję soli rozpuść w niewielkiej ilości wody i wlej roztwór do probówki. Dodaj roztwór węglanu sodu Na2CO3. W naczyniu powinien wytrącić się biały osad, a jeśli nic takiego nie zauważyłeś - ogrzej probówkę. Węglan litu Li2CO3 jest słabo rozpuszczalny w wodzie, a w dodatku jego rozpuszczalność maleje ze wzrostem temperatury. To nietypowy przypadek: rozpuszczalność większości związków rośnie wraz z ogrzewaniem roztworu, a poza tym sole pierwiastków grupy 1 - w tym i węglany - są dobrze rozpuszczalne. Osad wytrąci się również, gdy na roztwór chlorku litu podziałasz roztworem fosforanu lub fluorku sodu.
Wyniki reakcji świadczą, że lit nie jest zwykłym litowcem. Jego właściwości są nieco podobne do sąsiadów z grupy drugiej, a szczególnie do magnezu.
Spróbuj przeprowadzić analogiczne próby z magnezem: do roztworu soli tego pierwiastka (najłatwiej dostępne są chlorek lub siarczan) dodaj roztworu dowolnego rozpuszczalnego węglanu, fosforanu lub fluorku. W każdym przypadku otrzymasz osady białej barwy. Pamiętasz może wykrywanie dwutlenku węgla przy pomocy wody wapiennej? Tam też dochodzi do wytrącania osadu węglanu. Nie sądź jednak, że lit leży w niewłaściwym miejscu tablicy Mendelejewa. Jest on pierwiastkiem jednowartościowym, a pewna odrębność lidera grupy od pozostałych członków rodziny to reguła w układzie okresowym (patrz ramka: Kuzyni po przekątnej).
Za miesiąc kolejne litowce, już nieodbiegające od standardu grupy 1.
Krzysztof Orliński
Zobacz także:
"Żarłoczny" chlorek
Te, które tworzą sole - Fluorowce i fluor
Chemiczny kameleon