Te, które tworzą sole - Fluorowce i fluor

Fluorowce to nie tylko sztandarowy przykład pierwiastków niemetalicznych. W tej grupie, jak w żadnej innej, przedstawiciele różnią się stanem skupienia i barwą. Natomiast zmiany aktywności chemicznej pozostają w ich przypadku nadzwyczaj regularne. Wszystkie są do siebie podobne, ale każdy ma swój wyrazisty charakter.
Portret rodzinny
Przyjmijmy, że są cztery fluorowce. W tablicy układu okresowego widnieje ich co prawda sześć, ale realnie wykonasz eksperymenty tylko z pierwszą czwórką. Nie czuj jednak zawodu - większość chemików również nie ma szans na doświadczenia z najcięższymi pierwiastkami grupy 17 (patrz ramka: Brakujące fluorowce).
…to astat At i tennessine Ts. Ten ostatni wyprodukowano w roku 2010 w rosyjskim laboratorium jądrowym w Dubnej. Międzynarodowy zespół fizyków otrzymał aż sześć jąder(!) nowego pierwiastka, które jednak żyły ułamki sekundy. Nazwę nadano na cześć stanu Tennesse, w którym leży znane laboratorium jądrowe Oak Ridge (stamtąd pochodził izotop berkelu - surowiec do otrzymania pierwiastka 117).
Astat występuje na Ziemi jako składnik szeregów promieniotwórczych, ale naturalne izotopy tworzą się w bocznych odgałęzieniach szeregów i są bardzo nietrwałe (z gr. astatos = nietrwały). Szacuje się, że w danej chwili w skorupie ziemskiej znajdują się co najwyżej gramowe ilości astatu! Do celów badawczych wytwarza się izotopy o dłuższym okresie życia (liczonym w godzinach). Astat po raz pierwszy o został trzymany sztucznie w roku 1940, a dopiero potem stwierdzono jego obecność w naturze.
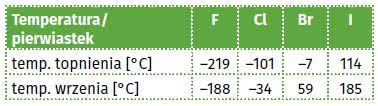
Fluor w temperaturze pokojowej i pod normalnym ciśnieniem jest żółtozielonym gazem. Chlor to również gaz, ale z bardziej zielonym odcieniem. Brom jest brunatnoczerwoną cieczą, a jod tworzy niebieskoczarne kryształy, które łatwo sublimują w postaci fioletowych par.
Astatu i tennessine nikt nie widział (i nie zanosi się, aby otrzymano ich dostrzegalne próbki). Dane dotyczące temperatur topnienia i wrzenia dla czterech pierwszych fluorowców znajdziesz w tabeli na końcu artykułu - na ich podstawie spróbuj oszacować odpowiednie wielkości dla astatu i tennessine (tak też postępują autorzy podręczników) (1).
W powierzchniowej warstwie Ziemi jest dość sporo dwóch pierwszych fluorowców. Pod względem rozpowszechnienia chlor zajmuje miejsce jedenaste (ok. 0,1% masy skorupy ziemskiej, wód i atmosfery), a fluor szesnaste (ok. 0,03%).
Brom i jod to pierwiastki śladowe, zajmujące odpowiednio miejsca 54 (ok. 0,0002%) i 65 (ok. 0,00005%). Główny składnik rozpuszczony w wodzie morskiej stanowi chlorek sodu, dużo jest również chlorku magnezu. Na drugim miejscu znajduje się brom, dopiero potem fluor, a jod ponownie zamyka stawkę. Wyjaśnieniem tej kolejności jest słaba rozpuszczalność minerałów zawierających fluor.
Fluorowce nie występują naturalnie w stanie wolnym, są na to zbyt reaktywne. Przeważnie spotkasz je w postaci jonów jednoujemnych (F-, Cl-, Br- i I-; gdy chodzi ogólnie o fluorowiec, używa się symbolu X, zatem anion to X-), w takiej też postaci stanowią składniki minerałów.
Nazwa fluorowce oznacza wszystkie pierwiastki z grupy 17. Cztery pierwsze to potocznie halogeny, czyli tytułowe "tworzące sole" (z gr. halos = sól, gennao = tworzę). Oprócz tych nazw używane jest również pojęcie chlorowce (chlor, brom i jod). Powodem są własności fluoru, które nieco odbiegają od cech pozostałych członków grupy. Nie jest to jednak anomalia, lecz prawidłowość w układzie okresowym - podobnie i inne czołowe pierwiastki "odstają" od reszty swojej rodziny. Fluorowce tworzą kwasy o ogólnym wzorze HX (przy czym HF jest stosunkowo słaby, pozostałe są mocne), a chlorowce również kwasy z udziałem tlenu. W stanie wolnym fluorowce występują jako dwuatomowe cząsteczki X2.
To tyle, jeśli chodzi o wspólny portret. Pora na prezentacje poszczególnych członków rodziny.
Najbardziej agresywny
Od XV wieku stosowano w hutnictwie minerał, który po dodaniu do rudy obniżał temperaturę jej wytopu. Nazwano go fluorytem, od łacińskiego fluere, czyli płynąć. Pod koniec XVIII wieku fluoryt dokładniej zbadano i stwierdzono, że składa się z ziemi wapniowej (tak wtedy nazywano CaO) i kwasu mającego zdolność trawienia szkła. Zgodnie z ówczesnymi poglądami uważano, że kwas ten musi zawierać tlen, ale nie udało się go wykryć.
Na początku XIX wieku zaakceptowano istnienie kwasów beztlenowych, a pierwiastkowi wchodzącemu w skład HF nadano nazwę fluor (od minerału). Próby wydzielenia go w stanie wolnym nie przyniosły rezultatu przez następne 75 lat. Dopiero francuski chemik Henri Moissan dokonał tego w roku 1886, przeprowadzając elektrolizę fluorku potasu w bezwodnym fluorowodorze (dziś najczęściej prowadzi się elektrolizę stopionych soli), za co dwadzieścia lat później otrzymał Nagrodę Nobla (2).
Wolny fluor to najbardziej aktywny niemetal, gwałtownie reagujący prawie ze wszystkimi pierwiastkami (opierają mu się tylko najlżejsze helowce). Jego agresja przysparza kłopotów podczas transportu, dlatego przewożony jest w miedzianych lub żelaznych butlach, których powierzchnie pokrywają się warstwami nierozpuszczalnych fluorków tych metali. Najważniejsze minerały fluoru to fluoryt (fluorek wapnia CaF2) (3) i kriolit (heksafluoroglinian sodu Na3AlF6), stosowane jako topniki. Inny minerał zawierający domieszkę fluoru to apatyt, główna ruda fosforu.
Fluor służy jako utleniacz w paliwach rakietowych oraz do syntezy fluorowych pochodnych węglowodorów i lotnego fluorku uranu (umożliwia rozdzielanie izotopów tego metalu na potrzeby militarne i energetyki jądrowej).
Z popularnych związków fluoru trzeba jeszcze wymienić szkodliwy dla zdrowia fluorowodór stosowany do trawienia szkła (rozpuszcza krzemionkę) oraz fluorek sodu wchodzący w skład past do zębów. Jony fluorkowe zostają wbudowane w szkliwo, tworząc odporny na działanie kwasów fluoroapatyt - należy pamiętać tylko, aby nie przedawkować preparatów fluoru, ponieważ w większych dawkach działają toksycznie (niszczą kości).
Fluor tworzy również szereg związków organicznych o dużym znaczeniu, np. teflon i freony. Te ostatnie to pochodne węglowodorów z chlorem i fluorem, które od lat wzbudzają dużo kontrowersji. Do niedawna były powszechnie stosowane jako czynnik chłodniczy w lodówkach i klimatyzatorach oraz gaz nośny w pojemnikach ciśnieniowych (np. dezodoranty). Obecnie freony eliminuje się z wielu dawnych zastosowań, a powodem jest - paradoksalnie - ich niezwykle mała reaktywność. Dzięki niej duża część dotychczasowej produkcji nadal znajduje się w ziemskiej atmosferze. Są nietoksyczne, ale oskarża się je o niszczenie warstwy ozonowej.
Wróg szkła
Potrzebny będzie teraz fluorek sodu NaF oraz stężony roztwór kwasu siarkowego(VI) H2SO4.
Na kawałek zwykłego szkła okiennego nasyp niewielką ilość NaF i zwilż kryształy roztworem kwasu. Doświadczenie wykonaj na zewnątrz lub pod wyciągiem - wydziela się bowiem szkodliwy fluorowodór. Po około godzinie zmyj szkło (obowiązują gumowe rękawiczki – masz do czynienia z H2SO4) i obejrzyj jego powierzchnię. Zauważysz ślady zniszczenia spowodowane działaniem związków fluoru. W pierwszym etapie następuje wypieranie dość słabego kwasu fluorowodorowego z jego soli przez kwas mocniejszy:
2NaF+H2SO4 → 2HF+ Na2SO4 →
Następnie HF reaguje z zawartą w szkle krzemionką:
SiO2+4HF → SiF4 ↑ +2H2O
Ta prosta w wykonaniu próba służy w analityce chemicznej do wykrywania fluorków (żaden inny anion nie daje takiego wyniku próby) (4).
Z żelazem
Anion fluorkowy F- chętnie łączy się z kationem żelaza(III) Fe3+ w jon kompleksowy o wzorze FeF63-. Do eksperymentu, który to potwierdzi, potrzebne będą: fluorek sodu NaF i chlorek żelaza(III) FeCl3.
Do probówki z roztworem soli żelaza wlej niewielką ilość roztworu fluorku sodu. Od razu widać efekt: żółtawe zabarwienie niknie, a zawartość naczynia staje się przezroczysta (może pojawić się lekkie białe zmętnienie, ponieważ powstający Na3FeF6 jest słabo rozpuszczalny) (5).
Powinowactwo anionu fluorkowego do żelaza(III) jest tak duże, że potrafi on rozłożyć inne związki tego metalu, aby się z nim połączyć. Jeśli masz rodanek potasu KSCN, możesz się przekonać o tej zdolności anionu F-. Do probówki zawierającej żółtawy roztwór FeCl3 wlej nieco bezbarwnego roztworu rodanku. Zawartość przyjmuje krwistoczerwone zabarwienie. Jednak po dodaniu roztworu fluorku sodu "chemiczna krew" (związek jest wykorzystywany jako imitacja prawdziwej krwi, np. w filmach) znika, a roztwór staje się przezroczysty. Zaobserwowałeś rozkład kompleksu rodankowego i powstanie fluorkowego, co sygnalizują zmiany koloru.
Analityka chemiczna często wykorzystuje przeprowadzone przez ciebie próby. Jednym z przypadków jest wykrywanie jonów Cu2+ w obecności Fe3+ (często występujących razem w jednym roztworze, np. podczas badania rud miedzi). Sporządź roztwory CuSO4 oraz FeCl3. Potrzebne ci będą jeszcze: NaF oraz K4[Fe(CN)6], czyli heksacyjanożelazian(II) potasu (potocznie żelazocyjanek potasu; tworzy bladożółte kryształy). Ten ostatni związek jest czułym odczynnikiem do wykrywania zarówno miedzi, z którą daje czerwonobrunatny osad, jak i żelaza(III) - w tym przypadku tworzy się ciemnoniebieskiej barwy tzw. błękit pruski (wykonaj obie próby, aby zobaczyć barwy powstających połączeń) (6). Jednak w przypadku mieszaniny kationów zawodzi.
W dwóch probówkach zmieszaj roztwory soli miedzi i żelaza(III) – otrzymasz ciecze o zielonożółtej barwie. Po dodaniu do pierwszej probówki roztworu żelazocyjanku potasu powstanie ciemne zabarwienie, na podstawie którego nie można stwierdzić obecności jonów Cu2+ (7).
Do drugiej próbówki wlej najpierw roztwór NaF- od razu pojawia się błękitna barwa pochodząca od uwodnionych jonów miedzi. Gdy teraz dodasz roztwór żelazocyjanku potasu, nie będzie problemów z potwierdzeniem obecności Cu2+ w próbce - brunatne zabarwienie ukaże się w całej okazałości (8). Czynność polegająca na "ukrywaniu" pewnych jonów tak, aby nie przeszkadzały w reakcji, to maskowanie.
Odmieniec
Fluor w roztworze występuje w postaci anionów F-, których własności odbiegają od analogicznych jonów pozostałych fluorowców. Oto dwa przykłady:
- chlorki, bromki i jodki wytrącają osady z jonami Ag+, fluorki – nie;
- fluorki wapnia, strontu i baru są trudnorozpuszczalne, analogiczne sole chlorowców - łatwo.
Mam nadzieję, że samodzielne wykonanie odpowiednich prób nie sprawi Ci żadnych trudności.
Krzysztof Orliński