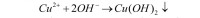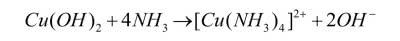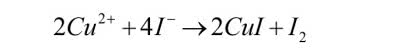Królewska rodzina. Królowa jest jedna (miedź) - część 1

Miedź wraz ze srebrem i złotem to wyjątkowa grupa pierwiastków. Jak rzadko które, poza żelazem, wpłynęły na los ludzkości. A ponieważ ich właściwości wyłamują się z reguł rządzących tablicą Mendelejewa (władcy niechętnie stosują się do praw ustanowionych dla innych), nie od rzeczy będzie stwierdzenie, że 11 grupa pierwiastków to …
…królewska rodzina
Na przykład wartościowość. Położenie w grupie 11 sugeruje, że będzie ona równa I. Jednak właśnie tyle wynosi tylko dla srebra (plus nietrwałe związki AgII). Dla miedzi jest równa I oraz II (najtrwalsza), a dla złota III (ale istnieje nawet złoto siedmiowartościowe). Barwa: miedź jest …miedziana (choć przekonasz się, że faktycznie ma inny kolor), srebro to srebrzystobiały metal, a złoto – po prostu złote. Takiego zróżnicowania kolorystycznego nie ma w żadnej innej grupie metali. Ludzkość poznała je wszystkie w głębokiej prehistorii, a od ich imion utworzyła nazwy mitycznych epok w dziejach świata. Po szczęśliwych wiekach złotym i srebrnym nastał …
…czas spiżu
To wtedy żyli Herakles, Tezeusz i Argonauci, a bohaterowie Homera pod murami Troi walczyli spiżowymi mieczami zakuci w spiżowe pancerze. Spiż to jeden ze stopów miedzi należący do brązów (drugim składnikiem jest cyna, oprócz niej stosuje się także inne dodatki). Spiż i brąz to powszechne metale starożytności, dopóki nie zostały wyparte przez żelazo. W czasach nowożytnych używano je do produkcji pierwszych armat, do dziś odlewa się z nich pomniki i dzwony, a różne odmiany brązów stosuje jako części maszyn.
Epoka miedzi rzeczywiście zaistniała w dziejach ludzkości. Około 5 tys. lat p.n.e. prehistoryczni metalurgowie opanowali wytop tego metalu ze znajdowanych rud (do tej pory stosowano samorodki), a kamienne narzędzia ustąpiły miejsca wykonanym z miedzi. Choć miedź jest dość miękka i narzędzia szybko się tępiły, można je było ostrzyć, a zużyte - przetopić na nowe. Po wiekach do użytku wszedł brąz (około 3,5 tys. lat p.n.e.), wytopiony prawdopodobnie przypadkowo, gdy w palenisku znalazły się razem rudy miedzi i cyny. Panował ponad 2 tysiące lat, aż wyparło go żelazo, którego epoka trwa do dziś.
Łacińska nazwa miedzi pochodzi od Cypru, gdzie istniały znane w całym starożytnym świecie kopalnie "cypryjskiego metalu" (łac. cyprum aes). Nazwę przekształcono potem w cuprum i w wielu językach europejskich do dziś miedź ma podobne imię. W językach słowiańskich nazwa jest zbliżona do polskiej, co świadczy o jej powstawaniu w równie zamierzchłych czasach. Z kolei w języku greckim jest to chalkos, od nazwy miasta nad Morzem Egejskim.
Portret królowej
Miedź to ciężki metal o gęstości prawie 9 g/cm3, topiący się w temperaturze 1085 °C. Jako przewodnik ciepła i elektryczności ustępuje tylko srebru, a dzięki dużej kowalności można ją łatwo kształtować. Powierzchniowa warstwa Ziemi zawiera około 0,01% miedzi (24 miejsce na liście pierwiastków), jest zatem średnio rozpowszechniona. Oprócz nielicznych samorodków, występuje w postaci minerałów. Eksploatację rud ułatwia fakt, że tworzą one złoża w wielu miejscach (patrz: Cypryjski metal). Najważniejsze ze źródeł miedzi stanowią chalkopiryt CuFeS2 i kupryt Cu2O. Zielony malachit i błękitny azuryt to zasadowe węglany stosowane jako kamienie ozdobne.
Królowa pracuje
Miedź to obecnie metal numer 3 w światowej gospodarce. Do wielu zastosowań potrzebna jest w bardzo czystej postaci, dlatego produkcja nie polega tylko na wytopie z rudy. Surowa miedź jest poddawana oczyszczaniu elektrolitycznemu. Bloki miedzi z pieca hutniczego zanurzone są w roztworze CuSO4 i połączone z dodatnim biegunem źródła napięcia, natomiast biegun ujemny - z niewielkimi blokami czystego metalu.
Podczas przepuszczania prądu przez roztwór bloki "dodatnie”"ulegają rozpuszczaniu, a na blokach "ujemnych" osadza się metal (patrz: Rafinacja miedzi). Warunki elektrolizy są tak dobrane, że praktycznie osadza się tylko sama miedź, natomiast zanieczyszczenia pozostają w roztworze lub opadają na dno. Szczególnie cenny jest osad zwany szlamem anodowym. Zawiera on metale bardziej szlachetne od miedzi: srebro, złoto i platynę. Odzyskuje się je, a ich wartość pokrywa w znacznej części koszty wytwarzania. Rocznie produkuje się ok. 20 mln ton miedzi, a największym dostawcą jest Chile. Polski koncern KGHM rocznie wytwarza ponad 550 tys. ton tego metalu.
Miedź obecnie używana jest do produkcji kabli i przewodów elektrycznych, aparatury dla przemysłu chemicznego, rur centralnego ogrzewania, wężownic w piecykach gazowych, chłodnic i radiatorów. Duże zastosowanie mają również stopy miedzi. O brązach już wspomniano, inne popularne stopy to złociste mosiądze (z dodatkiem cynku). Te ostatnie również zostały otrzymane w starożytności, kiedy często używano ich jako imitacji złota.
Źródła miedzi
Ze zdobyciem miedzi nie będziesz miał trudności. Metal uzyskasz z przewodów elektrycznych po zdjęciu izolacji, blachę z miedzianych rurek. Najpopularniejszym związkiem miedzi jest siarczan(VI), występujący w postaci błękitnych kryształów soli uwodnionej o wzorze CuSO4×5H2O. "Siny kamień" (potoczna nazwa związku) nie jest drogim odczynnikiem, a najtaniej zaopatrzysz się w niego w sklepie ogrodniczym, ponieważ jest stosowany jako środek grzybobójczy.
Miedź nie jest toksyczna, choć jako metal ciężki nie jest także obojętna dla organizmu. Wystarczą zwykłe środki bezpieczeństwa stosowane w laboratorium, czyli nie jesz i nie pijesz podczas pracy, a próby wykonujesz tak, aby nie zabrudzić otoczenia. Jeśli dodatkowo używasz stężonych roztworów kwasów lub zasad, obowiązuje ochrona wzroku i skóry dłoni.
Jak wykryć miedź?
Najłatwiej po kolorze. To wcale nie żart, błękitna barwa roztworu jest wskazówką sygnalizującą obecność uwodnionych jonów Cu2+ (patrz: Zwierciadło Wenus). Jeśli więc zauważony zostanie taki kolor, przeprowadza się badania w kierunku wykrycia tego metalu. Poniżej kilka prób analitycznych dla miedzi.
Sporządź kilkuprocentowy roztwór CuSO4 oraz rozwór wodorotlenku sodu o takim samym stężeniu. Po zmieszaniu roztworów natychmiast wytrąca się niebieski osad:
Jest on praktycznie nierozpuszczalny w nadmiarze zasady, natomiast rozpuszcza się po dodaniu roztworu amoniaku NH3aq, a barwa roztworu staje się ciemniejsza niż początkowo. Powodem jest tworzenie jonów kompleksowych o ciemnoniebieskim kolorze:
Gdy na roztwór soli miedzi podziałasz tylko roztworem amoniaku, początkowo wytraci się niebieski osad (roztwór amoniaku ma odczyn zasadowy), który następnie rozpuści się z opisanym wcześniej efektem barwnym. Zapamiętaj to doświadczenie. Wytrącanie błękitnego osadu pod wpływem roztworu zasady i rozpuszczanie go po dodaniu roztworu amoniaku z utworzeniem ciemnoniebieskiego zabarwienia jest charakterystyczną próbą pozwalającą wykryć jony Cu2+. W przypadku małego stężenia miedzi w próbce amoniak powoduje pogłębienie barwy roztworu. Mierząc pochłanianie światła przez roztwór dla odpowiednio dobranej długości fali (w tym przypadku jest to dopełniająca barwa z zakresu żółtego), wyznacza się zawartość miedzi w roztworze.
Jeszcze czulszym odczynnikiem niż amoniak jest K4[Fe(CN)6], czyli heksacyjanożelazian(II) potasu. Potocznie to żelazocyjanek potasu, występujący w postaci jasnożółtawych kryształów. Nie pomyl go z tworzącym czerwone kryształy żelazicyjankiem K3[Fe(CN)6], inaczej doświadczenie nie wyjdzie. Odczynnik z jonami Cu2+ daje czerwonobrunatny osad Cu2[Fe(CN)6], a w przypadku bardzo małego stężenia miedzi - czerwonawe zabarwienie roztworu.
Chlorek i bromek miedzi(II) są rozpuszczalne w wodzie, natomiast jodek sprawia niespodziankę. Po dodaniu roztworu jodku potasu KI wytrąca się ciemny osad. Jeśli do probówki dodasz nieco zawiesiny skrobi (czyli po prostu mąki ziemniaczanej) otrzymasz ciemnogranatowe zabarwienie. Z pewnością wiesz, co oznacza taki wynik próby - w naczyniu znajduje się wolny jod, który powstał w reakcji:
Za efekt odpowiadają utleniające własności jonów Cu2+ (o nich więcej za miesiąc) i redukujące jodków.
Miedź można wykryć jeszcze prościej: wystarczy palnik gazowy (może być nawet kuchenki) i metalowy drucik. W laboratoriach używa się drucików platynowych, ale wystarczy ci zwykły stalowy, osadzony w kawałku drewna. Ureguluj płomień palnika tak, aby był on stabilny i bezbarwny. Drucik zanurz w kwasie solnym i wprowadź do płomienia, co oczyści powierzchnię metalu. Gdy płomień przestanie się barwić, dotknij końcem drucika dowolnej soli miedzi tak, aby do końca przykleił się kryształek związku (gdy nie chce, zwilż drucik wodą destylowaną). Po wprowadzeniu próbki do płomienia, związki miedzi zabarwią go na zielono, a w przypadku chlorku - niebiesko-zielono. [analiza_płomieniowa]
Sam sprawdź jak przebiega oczyszczanie miedzi. Do przewodów połączonych z biegunami baterii o napięciu 4,5 V przymocuj pozbawione izolacji miedziane druty. W zlewce rozpuść nieco siarczanu(VI) miedzi(II) CuSO4 i dodaj kilka kropel kwasu siarkowego(VI) H2SO4. Włóż druty do zlewki i przepuszczaj prąd przez roztwór. Już po godzinie zauważysz, że "dodatni" drucik schudł, a "ujemny" nabrał ciała.
W zielonej kreacji
Oprócz błękitów, królowa przywdziewa również zielone szaty. I nie jest to tylko stonowana patyna (zasadowy węglan tworzący się np. na miedzianych dachach), ale i soczysta zieleń. Sporządź roztwór CuSO4 oraz stężony roztwór NaCl, czyli soli kuchennej. Do błękitnego roztworu soli miedzi wlej roztwór soli. Pojawia się zielona barwa. Teraz dolej wody. Wraca niebieski kolor.
Skąd te zmiany? Błękit to uwodnione jony Cu2+. Po wpływem dużego stężenia chlorku sodu część jonów miedzi tworzy aniony CuCl4 2− o żółtej barwie. Żółty + niebieski = zielony. Rozcieńczenie wodą powoduje rozpad kompleksu chlorkowego i powrót niebieskiej barwy.
Zwierciadło Wenus
Afrodyta jest również mieszkanką Cypru, gdzie pewnego dnia wyłoniła się z morza na wybrzeżu wyspy. Alchemicy skojarzyli miedź z jej rzymską odpowiedniczką - Wenus, a także z poświęconą jej planetą. Metal oraz planetę oznaczali symbolem ♀, czyli zwierciadłem Wenus (znak symbolizuje lusterko z uchwytem; miedziane lustra znamy z wykopalisk). Nic zatem dziwnego, że i miedź gustuje w morskich barwach - błękitach i zieleniach (takie są kolory wielu jej połączeń).
Krzysztof Orliński