Ponurak (ołów) - część 2

Ponieważ chemika musi charakteryzować rozwaga podczas eksperymentowania, przed przystąpieniem do pracy przypomnij sobie zamieszczone miesiąc temu zasady laboratoryjnego BHP dotyczące wykonywania prób z ołowiem i jego związkami.
Halogenki
W poprzednim odcinku zaobserwowałeś, że chlorki srebra i ołowiu(II) są słabo rozpuszczalne w wodzie. Osad PbCl2 powstaje jednak tylko w niezbyt rozcieńczonych roztworach, a do tego w gorącej wodzie dość dobrze się rozpuszcza i nie rozkłada na świetle (jak to jest w przypadku AgCl). Podobnie do analogicznych związków srebra, trudno rozpuszczalne osady powstają również w reakcji jonów Pb2+ z bromkami i jodkami. Zwłaszcza ten ostatni związek jest bardzo ciekawy: barwy złocistożółtej, rozpuszczalny w gorącej wodzie, po ochłodzeniu wytrąca się w postaci błyszczących kryształów. Przypomnę ci tylko, że i jodek srebra AgI ma żółtawą barwę (1).
Jeżeli wytrącanie jodku ołowiu przeprowadzisz w większym naczyniu (np. kolbie), efekt będzie bardziej widowiskowy niż w przypadku doświadczenia wykonanego w probówce. Przygotuj kilkuprocentowe roztwory dobrze rozpuszczalnej soli ołowiu (azotan lub octan) oraz jodku potasu. Do kolby z roztworem związku ołowiu wlej porcję roztworu KI (unikaj nadmiaru, ponieważ powstający osad się rozpuści). Wytrącony żółty osad lepiej rozpuszcza się w gorącej wodzie. Po wstawieniu kolby do naczynia z wrzątkiem osad zniknie, a roztwór stanie się jedynie lekko żółtawy. Pozostaw kolbę do ostygnięcia, usiądź wygodnie i obserwuj rozpoczynający się spektakl. Szybko zaczynają pojawiać się kryształy w postaci złocistych blaszek, gdy zaś oświetlisz naczynie z boku, zobaczysz padający złoty deszcz (tak opisuje się to doświadczenie, filmów w Internecie szukaj również pod angielską nazwą golden rain). Gdy zamieszasz zawartością kolby, w naczyniu zacznie szaleć zimowa zamieć z wirującymi złocistymi płatkami śniegu (2).
Reakcja, która przeprowadziłeś, jest próbą służącą do wykrywania obu jonów. Przed tobą jeszcze jedna porcja analityki, tym razem ołów…
…w grupie z barem
W ubiegłym miesiącu dowiedziałeś się, że obecność ołowiu w próbce stwierdza się w I grupie analitycznej kationów wraz ze srebrem. Tytuł rozdziału nie jest jednak pomyłką, ołów można wykrywać również w grupie II razem z wapniowcami: wapniem, strontem i barem (szczególne podobieństwo łączy go z tym ostatnim metalem). Powodem jest stosunkowo duża rozpuszczalność PbCl2, związku, który tworzy się pod wpływem działania roztworu HCl (odczynnika grupowego dla grupy I). Co prawda chlorek ołowiu(II) opisany jest jako słabo rozpuszczalny, ale - w przeciwieństwie do praktycznie nierozpuszczalnego chlorku srebra - może się zdarzyć, że jego osad nie wytrąci się w warunkach reakcji (np. przy małym stężeniu jonów Pb2+ w roztworze lub w zbyt wysokiej temperaturze) i obecność ołowiu nie zostanie wykryta. Zwykle również część chlorku ołowiu przechodzi do roztworu po oddzieleniu osadu i ulega reakcji z odczynnikiem grupowym dla grupy II - kwasem siarkowym(VI) H2SO4.
Przygotuj roztwory: soli ołowiu (azotan lub octan), baru (najlepiej azotan), kwasu siarkowego(VI) stężeniu około 10%, chromianu(VI) potasu K2CrO4. Zamiast kwasu siarkowego możesz użyć rozpuszczalnego siarczanu, np. Na2SO4. Próby wykonaj w małej skali na specjalnej płytce porcelanowej z wgłębieniami, a jeżeli jej nie masz - użyj blistra po tabletkach lub zwykłej folii.
Przeprowadź cztery reakcje: zarówno kationu ołowiu, jak i baru z anionem siarczanowym i chromianowym. Do dwóch zagłębień w płytce lub blistrze wpuść po kropli roztworu soli ołowiu, do kolejnych dwóch - soli baru. W przypadku użycia folii nanieś krople na jej powierzchnię tak, aby się ze sobą nie zlały. Oczywiście pamiętaj, aby używać oddzielnych zakraplaczy lub bagietek do każdego z odczynników - jeśli je zanieczyścisz, stosując ten sam przyrząd, zafałszujesz wyniki prób. Do jednego z zagłębień z roztworem soli ołowiu i jednego z roztworem soli baru wpuść po kropli roztworu kwasu siarkowego (lub siarczanu), a do dwóch pozostałych - chromianu (podczas wykonania doświadczeń na folii po prostu upuść kroplę z zakraplacza lub bagietki na już leżącą kroplę). We wszystkich przypadkach powstały osady: siarczany PbSO4 i BaSO4 są białe, natomiast chromiany PbCrO4 i BaCrO4 - żółte. Obie sole ołowiu były stosowane jako pigmenty, natomiast związki baru do dziś są używane w tej roli (3).
Ołów i bar rzeczywiście reagują podobnie. Jak zatem odróżnić kationy Ba2+ i Pb2+ od siebie? Z pomocą przychodzi amfoteryczność związków ołowiu, czyli reagowanie jak zasada lub kwas w zależności od działającego odczynnika. O ile związki baru wykazują tylko charakter zasadowy (osad rozpuści się pod wpływem kwasu), o tyle połączenia ołowiu przereagują zarówno z kwasem (ujawnią swój charakter zasadowy), jak i zasadą (tym razem zachowają się jak kwas).
W probówce zmieszaj niewielkie ilości roztworów soli baru i ołowiu, a następnie dodaj roztwór K2CrO4. Zlej roztwór znad osadu, osad przepłucz wodą i ponownie odlej ciecz. Do próbówki dodaj 10-15% roztwór wodorotlenku sodu NaOH i dobrze zamieszaj zawartością (możesz również ogrzać probówkę). Zlej ciecz znad pozostałego osadu i po kropli dodawaj do niej roztwór kwasu octowego (może to być spożywczy ocet). Gdy cały wodorotlenek przereaguje, ponownie pojawi się żółty osad PbCrO4 (chromian baru nie jest rozpuszczalny w zasadzie i pozostał w pierwszej probówce). Jeżeli zamiast chromianów wytrącisz osad siarczanów, tok postępowania jest analogiczny - musisz tylko użyć bardziej stężonego roztworu wodorotlenku sodu. W ten sposób stwierdza się obecności ołowiu w osadzie zawierającym kationy II grupy analitycznej. Pozostawiam ci sprawdzenie, że wytrącony osad siarczanu lub chromianu baru (tylko jego, bez dodatku związku ołowiu) nie rozpuści się pod wpływem zasady.
Ołów to metal z pogranicza: w niektórych reakcjach podobny do srebra, w innych - do cięższych wapniowców, a zwłaszcza baru.
Metal alchemików dawnych…
Ołów to metal znany od prehistorii, więc i alchemicy często z nim eksperymentowali. Ponieważ w ich filozofii rzeczy ziemskie nieodłącznie związane były z niebiańskimi, metale połączono z ciałami niebieskimi. Ołów przydzielono Saturnowi, najdalszej ze znanych ówcześnie planet. Wybór okazał się trafny. Saturn był rzymskim odpowiednikiem greckiego Kronosa, tytana panującego nad światem zarania dziejów. Postać to kontrowersyjna: okaleczył sierpem i strącił z tronu swego ojca, zazdrosny panowanie, połykał własne dzieci, a sam został obalony przez syna = Zeusa. Mimo krwawych porachunków na szczytach niebiańskiej władzy, ludzie wspominali go dobrze, ponieważ rządy Kronosa to mityczny wiek złoty. Astronomicznym symbolem planety jest stylizowany sierp, atrybut Kronosa (rzymski Saturn to także bóg zasiewów i zbiorów), tym samym symbolem oznaczano ołów, metal ponury jak jego patron (4).
Ołów, obok rtęci, to najczęstszy alchemiczny surowiec do dokonania transmutacji, czyli przemiany w złoto. Być może to właśnie fakt znajdowania srebra w ołowiu (stanowi domieszkę w jego rudach) podsunął alchemikom myśl o możliwości przekształcenia jednych metali w inne, cenniejsze. Skoro w pospolitym ołowiu rodzi się srebro, to czemu nie złoto? A gdyby tak przyspieszyć procesy przebiegające w naturze?
Eksperymenty z ołowiem miały również cele praktyczne. Metal ten stanowił materiał do produkcji różnych przedmiotów, a jego związki okazały się użyteczne, na przykład jako barwniki. Istniało więc zapotrzebowania na udoskonalenie metod otrzymywania metalu oraz syntezy poszukiwanych substancji. W ciągu wieków odkryto wiele związków ołowiu, a jeden z nich umożliwi ci wykonanie eksperymentu, którym popisywali się już przodkowie współczesnych chemików.
organizmu człowieka oraz toksyczne działanie na organizmy wodne
Jest nim octan ołowiu(II) (CH3COO)2Pb, od czasów alchemików znany jako cukier ołowiany. Związek występuje w postaci białych kryształów, jest bardzo dobrze rozpuszczalny w wodzie i ma słodkawy smak (tego oczywiście nie sprawdzisz!), ale to prawdziwa biała śmierć (tak czasem nazywany jest zwykły cukier).
Jak wszystkie związki ołowiu, a zwłaszcza rozpuszczalne w wodzie, jest bardzo szkodliwy, zachowaj zatem wzmożone środki ostrożności podczas próby (5). Potrzebną ci cynkową blachę pozyskasz ze zużytego ogniwa jednorazowego, sprawdź tylko, czy oznaczenie na etykiecie rozpoczyna się od litery R (ogniwa z oznaczeniem LR mają obudowę stalową, a nie cynkową). Z oczyszczonej blachy wytnij kształt choinki, umocuj ją na nitce i całość zawieś w zlewce napełnionej 5% roztworem octanu ołowiu. Wkrótce metaliczny ołów, wyparty z roztworu przez aktywniejszy od niego cynk, osadzi się na wyciętym kształcie w postaci ciemnych kryształów. Jeżeli oświetlisz zlewkę latarką, drzewko zabłyśnie jak prawdziwa choinka pokryta śniegiem. Zauroczeni efektem próby alchemicy opisali doświadczenie - na część patrona ołowiu - jako drzewko Saturna (6).
…i współczesnych
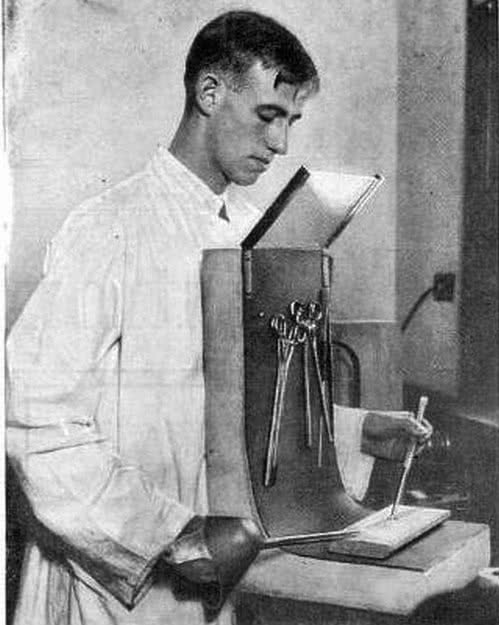
Transmutację udało się przeprowadzić dopiero w XX wieku. Współcześni alchemicy, czyli fizycy jądrowi, przekształcili rtęć w złoto (zatem dawni mistrzowie nie mylili się!). Produkcja okazała się jednak zupełnie nieopłacalna ekonomicznie - sztuczne złoto jest wielokrotnie droższe od naturalnego. Ale już na serio: bez ołowiu nie istniałaby energetyka jądrowa ani nie byłoby możliwe posługiwanie się izotopami promieniotwórczymi. Ołów jako pierwiastek dużej liczbie atomowej wydajnie pochłania promieniowanie i dzięki temu służy jako materiał na osłony dla substancji radioaktywnych (7).
(na zdjęciu: laborant, osłonięty przez ołowianą konstrukcję,
przeprowadza operacje z radem, ok. 1920)
Występujące w przyrodzie, trwałe izotopy Pb-206, Pb-207 i Pb-208 są końcowymi produktami przemian naturalnych pierwiastków promieniotwórczych wywodzących się z uranu i toru. Badając proporcje zawartości izotopów ołowiu do odpowiednich izotopów uranu i toru w minerałach, można oszacować wiek skał, w skład których wchodzą. Izotop Pb-208 to trwały nuklid o największej masie, wszystkie cięższe od niego są promieniotwórcze. Kolejny pierwiastek, bizmut, jest nietrwały, ale okres połowicznego zaniku Bi-209 (czas, po którym rozpadnie się połowa początkowej ilości izotopu) miliard razy przewyższa wiek Wszechświata! Podziwu godna jest dokładność badań - w próbce o masie 1 grama w ciągu roku rozpadnie się tylko około 75 atomów bizmutu.
Krzysztof Orliński