Ponurak (ołów) - część 3

W ubiegłym miesiącu stare alchemiczne doświadczenie pozwoliło na otrzymanie drzewka Saturna, czyli kryształów ołowiu osadzonych na cynkowej blaszce wyciętej w kształt choinki. Proponuję ci powtórzenie eksperymentu, ale tym razem bez użycia cynku - ołów wydzielisz, jak na wiek pary i elektryczności przystało (który, następując po epoce alchemii, właściwie trwa nadal)…
…prądem
Przygotuj odpowiedni elektrolizer, czyli szalkę Petriego (możesz ją zastąpić zwykłym spodkiem). Jako źródło prądu wystarczy bateria o napięciu 4,5 V. Elektrodami są zwykłe stalowe spinacze (niepowleczone osłonką z tworzywa sztucznego). Jeden ze spinaczy nieco rozegnij, zamocuj na krawędzi naczynia i połącz z dodatnim biegunem baterii, drugi rozprostuj i połącz z biegunem ujemnym. Spinacz ten najlepiej zamocować w uchwycie statywu tak, aby nie poruszał się w trakcie eksperymentu. Na szalkę wlej roztwór octanu lub azotanu(V) ołowiu. Obie sole łatwo hydrolizują z wydzieleniem białej zawiesiny, dlatego dodaj do roztworu kilka kropli (nie więcej) kwasu octowego lub azotowego(V). Spinacz "ujemny" ustaw tak, aby tylko dotykał powierzchni cieczy, ale jej nie przebijał (to warunek decydujący o powodzeniu próby). Po włączeniu przepływu prądu wokół niego od razu zaczną się tworzyć struktury przypominające osobliwe, metalicznej barwy glony lub ośnieżone gałązki iglastego krzewu. Całość utrzymywana jest na powierzchni wody dzięki siłom napięcia powierzchniowego. Dokładna obserwacja pozwoli stwierdzić, że twory składają się z podobnych do siebie elementów - matematycy powiedzą, że mają strukturę fraktalną (1). Uważaj, aby nie poruszać całością, ponieważ gałązki łatwo odrywają się od spinacza. Jeżeli głębiej zanurzysz końcówkę, wynik nie będzie już tak atrakcyjny - powstanie tylko ciemny, bezpostaciowy osad metalicznego ołowiu.
Nietrwała czwórka
Przynależność ołowiu do grupy 14. sugeruje maksymalną wartościowość równą cztery. Tak jest w istocie, jednak w rodzinie zmienia się trwałość połączeń na najwyższym stopniu utlenienia. W przypadku węgla, krzemu i germanu praktycznie występują tylko związki, w których atom węglowca jest czterowartościowy. Cyna, sąsiadka ołowiu z góry, tworzy kationy Sn2+, ale łatwo ulegają one utlenieniu do związków Sn(IV). W przypadku ołowiu jest odwrotnie: to kationy Pb2+ są trwałe, natomiast ołów czterowartościowy to silny utleniacz, chętnie redukujący się do połączeń Pb(II).
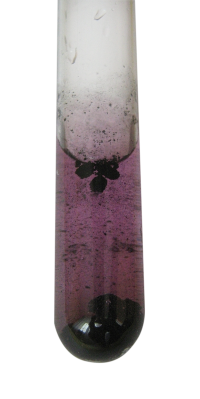
Do probówki wlej roztwór soli manganu(II), np. MnCl2 lub MnSO4. Możesz użyć również dwutlenku MnO2. Ten ostatni związek wydobędziesz ze zużytych ogniw jednorazowych (tego samego typu, z których miałeś blachę cynkową do wykonania drzewka Saturna). Czarną masę wypełniającą ogniwo zalej gorącą wodą, dobrze wymieszaj i odsącz. Osad zawiera m.in. MnO2. Do probówki z roztworem soli manganu lub osadem jego dwutlenku dodaj szczyptę dwutlenku ołowiu PbO2 lub minii Pb3O4 (to mieszany tlenek ołowiu dwu- i czterowartościowego) oraz 2 cm3 stężonego roztworu kwasu azotowego(V) HNO3. Ostrożnie ogrzewaj zawartość probówki do wrzenia (obowiązują okulary ochronne i rękawice - masz do czynienia ze stężonym kwasem), gotuj przez minutę, a następnie pozostaw do ostygnięcia. Gdy użyłeś MnO2, po ostygnięciu wlej nieco wody i zamieszaj zawartością probówki. W obu przypadkach zaobserwujesz fioletowe zabarwienie, które dla manganu wskazuje na obecność jonów nadmanganianowych.
Ołów(IV) to zatem bardzo silny utleniacz, silniejszy nawet od nadmanganianu, skoro zdołał utlenić związki manganu o niższej wartościowości do połączenia Mn(VII). Teraz już rozumiesz, dlaczego odradzałem stosowanie PbO2 lub minii do wytopu ołowiu (patrz pierwszy odcinek) - redukcja tlenku mogłaby przebiegać zbyt gwałtownie. Próba, która przeprowadziłeś, służy do identyfikacji manganu i nosi nazwę reakcji Cruma (2).
Zabójca białek
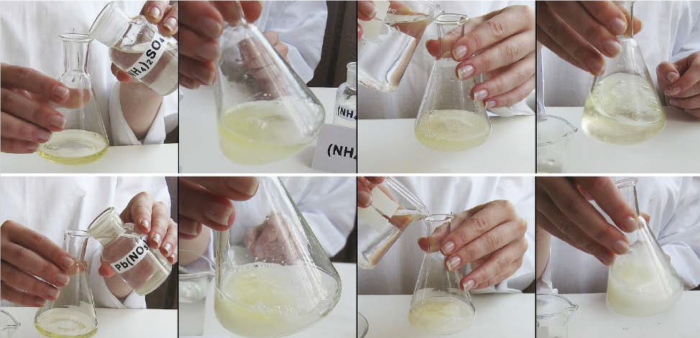
Metale ciężkie, w tym i ołów, szkodliwie działają na białka, powodując nieodwracalne zmiany w ich strukturze. Przygotuj roztwór białka jaja kurzego w wodzie oraz roztwory soli kuchennej i azotanu(V) lub octanu ołowiu. Do dwóch kolb nalej roztworu białka, a następnie do pierwszej z nich niewielką ilość roztworu NaCl, do drugiej - roztworu soli ołowiu. W obu naczyniach tworzą się białe kłaczki wydzielające się z wody (mówimy, że nastąpiła koagulacja białka, które wytrąciło się z utworzonego przez nie roztworu koloidalnego). Po opadnięciu kłaczków na dno odlej ciecz, dodaj czystej wody i zamieszaj. Skoagulowane białko, który wytrąciłeś za pomocą soli kuchennej, rozpuszcza się (proces ten to peptyzacja), natomiast w drugiej kolbie nawet długie mieszanie nic nie da - białka nie da się już rozpuścić ponownie. W pierwszej kolbie nastąpiło wysalanie, czyli wytrącenie pod wpływem soli, natomiast w drugiej - nieodwracalna denaturacja.
Skąd te różnice? Oba związki są solami, dysocjują na jony i wykazują wiele podobieństw. Różnicą jest mechanizm działania na białka. W pierwszym przypadku jony sodu (ogólnie jony metali lekkich) "zabierają" tylko cząsteczki wody otaczające molekuły białka. Efektem jest "sklejanie się" białek, które koagulują, jednak bez zmian struktury, a dodatek wody powoduje ponowne ich rozpuszczenie. W drugim przypadku jony ołowiu, jak również rtęci i wielu innych metali ciężkich, reagują z aminokwasami, co powoduje rozrywanie wiązań stabilizujących struktury przestrzenne białek. Tym razem dodatek wody nie jest w stanie odtworzyć pierwotnego kształtu cząsteczek - wytrącone kłaczki się nie rozpuszczają (3).
analogiczne do soli kamiennej NaCl).
U dołu: sól ołowiu powoduje nieodwracalną denaturację białka
Utrzyj na tarce kawałek ziemniaka i papkę zalej wodą. Poczekaj, aż zawiesina opadnie na dno i zlej ciecz znad osadu. W roztworze znajduje się m.in. katalaza - enzym rozkładający nadtlenek wodoru H2O2. W statywie umieść dwie probówki i do każdej z nich wlej po 5 cm3 wyciągu ziemniaczanego. Statyw koniecznie ustaw na większej tacy. Do jednej z probówek dodaj również niewielką ilość roztworu rozpuszczalnej soli ołowiu. Teraz do obu z nich dodaj po 1 cm3 wody utlenionej. W probówce bez dodatku soli ołowiu trwa burzliwa reakcja rozkładu H2O2: zawartość silnie się pieni, może nawet "wyjść" z naczynia (dlatego zalecałem ci przeprowadzenie próby na tacy). W probówce zawierające ołów nic się nie dzieje - nasz ponurak zdenaturował białkowy enzym (4).
W związku z siarką
Ołów chętnie łączy się z siarką, siarczkiem o wzorze PbS jest najważniejszy minerał ołowiu - galena (srebro również ma te właściwości, stąd jego obecność w galenie). Powinowactwo siarki i ołowiu jest tak duże, że zwiążą się nawet wtedy, gdy będą w innych związkach. Przygotuj roztwór białka jaja kurzego, wlej go do probówki i dodaj taką samą objętość 20-30% roztworu wodorotlenku sodu NaOH. Następnie wlej kilka cm3 roztworu octanu ołowiu i probówkę umieść w naczyniu z gorącą wodą. Wkrótce zwartość probówki ciemnieje. W silnie zasadowym środowisku białka zawierające siarkę (jest ona obecna w aminokwasach cysteinie i metioninie) ulegają rozkładowi, a następnie jony ołowiu łączą się z uwolnionymi anionami siarczkowymi, tworząc ciemną zawiesinę nierozpuszczalnego PbS (5).
i soli ołowiu ciemnieje po ogrzaniu - tworzy się siarczek ołowiu
Nie kończ jeszcze doświadczenia. Do probówki wlej niewielką ilość wody utlenionej (pamiętaj o postawieniu naczynia z probówką na tacy). Nadtlenek wodoru ulega rozkładowi, co zaobserwujesz jako pianę na powierzchni cieczy, ale równocześnie zawartość probówki staje się biała. To efekt utleniania ciemnego siarczku PbS do białego siarczanu(VI) PbSO4 (6). Reakcja, którą przeprowadziłeś, jest wykorzystywana przez konserwatorów dzieł sztuki. Powszechnie stosowane w dawnych czasach białe farby ołowiane (mieszanina wodorotlenku i węglanu ołowiu) z biegiem lat uległy działaniu związków siarki obecnych w powietrzu i sczerniały. Przetarcie powierzchni obrazu roztworem H2O2 powoduje przemianę ciemnego siarczku w biały siarczan, co przywraca dziełu pierwotny wygląd.
wody utlenionej przechodzi w biały siarczan (probówka po prawej)
Polski ołów…
…jest znany od co najmniej XII wieku. W każdym razie z tego okresu pochodzą wzmianki o kopalnictwie rud ołowiu na terenach położonych pomiędzy Olkuszem i Bytomiem (chociaż z wykopalisk archeologicznych wynika, że prowadzono tam działalność górniczo-hutniczą znacznie wcześniej, nawet w okresie rzymskim). Z ołowiu uzyskiwano także srebro, a w późniejszym okresie wydobywano również rudy cynku. Polskie złoża przez wieki zaopatrywały całą Europę w znaczne ilości tych metali. Szacuje się, że od średniowiecza dostarczyły około 15 mln ton cynku i 4 mln ton ołowiu. Ostatnią czynną kopalnię w Olkuszu-Pomorzanach zamknięto w roku 2020 z powodu wyczerpania złóż, ale nadal działają huty cynku i ołowiu. Ołów otrzymywany jest również przez KGHM jako produkt uboczny podczas wytwarzania miedzi (7). Duże, nieeksploatowane dotychczas, złoża rud cynku i ołowiu znajdują się w rejonie Zawiercia. Kanadyjska spółka Rathdowney zamierza uruchomić wydobycie tych surowców, jednak lokalne społeczności protestuję, nie chcąc mieć na swoim terenie inwestycji tak mocno wpływającej na środowisko.
Ołów to pierwiastek o niebezpiecznej naturze, szkodliwy dla świata ożywionego, lecz jego cenne właściwości powodują, że nadal jest i będzie w użyciu. Z ołowiem, jak i wielu innymi niebezpiecznymi materiałami, trzeba po prostu nauczyć się obchodzić - tak, aby nie narazić siebie i innych, a wykorzystać jego zalety. Pierwszym krokiem jest oczywiście wiedza o ołowiu, dzięki której ponury metal Saturna ukaże pogodniejszą twarz.
Pierwiastek 114 zostałby nazwany przez Mendlejewa ekaołowiem, ale od 2011 roku nosi nazwę flerow i ma symbol Fl. Został wyprodukowany w roku 1998 w rosyjskim laboratorium w Dubnej, a nazwę nadano mu na cześć znanego fizyka jądrowego Gieorgija Florowa. Z dotychczas nieotrzymanym flerowem-298 wiązane są duże nadzieje. Niektóre izotopy odznaczają się znaczną trwałością spowodowaną tzw. liczbami magicznymi protonów i neutronów w ich jądrach. Nie wnikając w szczegóły: najcięższy naturalny trwały izotop Pb208 ma magiczne liczby protonów (82) i neutronów (126). Podwójnie magiczne jest również jądro o 114 protonach i 184 neutronach, co powoduje, że izotop Fl-298 powinien mieć wyjątkowo długi czas życia, szacowany nawet na setki milionów lat. Niestety do tej pory nie udała się synteza tego jądra ani poszukiwania na Ziemi, gdzie, jako kolejny pierwiastek w grupie, powinien występować w rudach ołowiu.
Krzysztof Orliński
Zobacz także:
Ponurak (ołów) - część 1
Ponurak (ołów) - część 2