Chemia jajka - część 2

Oba składniki, a zwłaszcza żółtko, to rzeczywiście najcenniejsze składniki jajka, wszak z nich musi wyrosnąć nowy organizm. Obie części to również wdzięczny obiekt do domowego eksperymentowania, zapraszam zatem do wspólnej pracy.
O jajku statystycznie
Przeciętne jajko kurze waży 50-60 gramów przy objętości wynoszącej około 50 cm³. Skorupka chroniąca wnętrze stanowi w przybliżeniu 10% masy całości, z czego, jak już wiesz, 95% to węglan wapnia (z drobną domieszką innych składników nieorganicznych), a reszta - związki białkowe. Znajdujące się pod skorupką białko to w przybliżeniu 60% masy całego jajka. Jest ono około 15% roztworem białek zapewniającym ochronę żółtka przed wstrząsami (widoczne w surowym białku "sznureczki" - chalazy - utrzymują żółtko w położeniu centralnym) oraz rezerwuarem wody. Żółtko, stanowiące około 30% masy całego jajka, to z kolei gęsta mieszanina wody (mniej niż połowa masy) z białkami (1/3 suchej masy) i lipidami (2/3 suchej masy) oraz związkami nieorganicznymi.
Jajko wybite ze skorupki składa się w 3/4 z wody, w reszcie zaś po połowie z białek i lipidów. Całe jajo dostarcza około 7 gramów białka o bardzo dobrym zestawie aminokwasów, dużej ilości niezbędnych nienasyconych kwasów tłuszczowych (NNTK), witamin A, B, D, E i K, luteiny korzystnie wpływającej na wzrok, lecytyny i choliny poprawiających zdolności uczenia się oraz składników mineralnych (Fe, Mg, Ca, P, Na, K, S) (1).
W jajku znajduje się również cholesterol, składnik naszej diety mający od dawna zdecydowanie złą prasę. Obecnie jednak odchodzi się od eliminowania jaj z jadłospisu, a Światowa Organizacja Zdrowia wręcz zaleca, aby zdrowi ludzie jedli od jednego do dwóch jaj dziennie (tygodniowo 7-10). Oczywiście, również w tym przypadku najważniejszy jest rozsądek i zróżnicowana dieta zawierająca możliwe mało przetworzone składniki.
Żółtawe białko
Kolor półpłynnej części jajka pochodzi od ryboflawiny, czyli witaminy B2, obecnej w dość dużej ilości w białku. Po ugotowaniu barwa zanika i białko rzeczywiście staje się białe. Z białkiem jaja wykonałeś kilka doświadczeń przy okazji eksperymentów z ołowiem otrzymywanie siarczku ołowiu i nieodwracalną denaturację pod wpływem jego soli. Powtórz fragment drugiej próby.
Przygotuj dość stężony roztwór białka jaja, mieszając je z wodą w proporcji 1:2-1:4 (więcej wody). Sporządź również nasycony roztwór soli kuchennej NaCl. Gorąca woda przyspieszy rozpuszczanie soli, ale praktycznie nie zwiększy jej stężenia - rozpuszczalność chlorku sodu jedynie w bardzo niewielkim stopniu zwiększa się wraz ze wzrostem temperatury. Przed próbą ostudź roztwór tak, aby nie "ugotować" białka.
Roztwór białka jest dość gęsty, ciągnący się, w wyraźnie żółtawym kolorze. Zacznij dodawać po kropli roztwór soli i cały czas mieszaj zawartość naczynia. Jeżeli spodziewałeś się wyniku podobnego, jak w doświadczeniu z koagulacją białka pod wpływem soli, czyli wytrącania osadu, możesz być zaskoczony. Mieszanina początkowo staje się jaśniejsza, bardziej ruchliwa, mniej gęsta. Dopiero kolejne porcje solanki wywołują oczekiwany efekt - w cieczy pojawiają się kłaczki białka. Jeżeli teraz dolejesz czystej wody zamiast roztworu NaCl, wytrącone białko rozpuści się.
Cząsteczki białek, ze względu na swoje gigantyczne rozmiary, nie są w stanie utworzyć roztworu właściwego w wodzie, jak np. sól kuchenna czy cukier, lecz roztwór koloidalny. Pierwsza porcja solanki wywołała zjawisko określane jako wsalanie. Molekuły białka mają liczne fragmenty polarne, w związku z czym przyciągają jony, najczęściej jednego znaku. W ten sposób jednoimiennie naładowane cząsteczki odpychają się od siebie, co zapobiega ich "sklejaniu" i zwiększa rozpuszczalność białka. Dalszy wzrost stężenia jonów działa jednak przeciwnie: otaczają się one cząsteczkami wody "zabieranymi" molekułom białka. Te zaś zbliżają się do siebie, łączą i koagulują (wytrącają z roztworu). Zjawisko to określa się z kolei jako wysalanie. Dodatek większej ilości wody powoduje peptyzację osadu, czyli ponowne rozpuszczenie białek (2).
solanki staje się bardziej przezroczysty (wsalanie, 2).
Większa ilość roztworu soli powoduje wytrącanie osadu
białka (wysalanie, 3). Po dodaniu czystej wody osad
rozpuszcza się (peptyzacja, 4)
Zjawisko wysalania jest wykorzystywane do rozdzielania białek na poszczególne frakcje (rozpuszczanie i wytrącanie zachodzi przy różnych stężeniach soli i odczynie roztworu), ale i w sztuce kulinarnej. Podczas ubijania piany z białek przepisy zalecają dodanie szczypty soli - cząsteczki białek zaadsorbują jony na swojej powierzchni i nie będą miały tendencji do sklejania się, a w efekcie piana stanie się trwalsza. Pamiętaj jednaj, aby dodać tylko odrobinę soli, inaczej powstaną kłaczki wytrąconego białka.
Białko jaja jest wdzięcznym obiektem jednej z reakcji charakterystycznych dla białek - próby biuretowej. Do białka rozpuszczonego w wodzie dodaj porcję roztworu wodorotlenku sodu NaOH, następnie zaś roztworu siarczanu(VI) miedzi(II) CuSO4. W naczyniu powstanie fioletowe zabarwienie, a w przypadku większego stężenia białka - również "kluch" zdenaturowanej substancji organicznej. Reakcja zachodzi w obecności białek i peptydów, a wykrywa obecność wiązań peptydowych położonych obok siebie i przedzielonych co najwyżej jednym atomem węgla. Powstający związek kompleksowy miedzi(II) ma fioletowe zabarwienie. Próbę wykorzystuje się m.in. w analityce medycznej do wykrywania białek w płynach ustrojowych (intensywność barwy jest proporcjonalna do ich stężenia) (3).
Natomiast próba ksantoproteinowa, druga z reakcji służących do wykrywania białek, nie powiedzie się w przypadku białka jaja kurzego. Reakcja ze stężonym roztworem kwasu azotowego(V) HNO3 prowadząca do żółtego zabarwienia substancji białkowej (po dodaniu wodorotlenku sodu zmienia się ono na pomarańczowe) wymaga obecności w niej aminokwasów zawierających pierścień benzenowy: fenyloalaniny, tryptofanu i tyrozyny. W albuminach, głównym składniku białka jaja, znajduje się bardzo mało tych aminokwasów i wynik próby jest niewidoczny (ze spożywczych surowców do jej wykonania bardzo dobrze sprawdzi się biały twaróg).
Z białka jaja można zrobić bezy, ale ma ono także …
…zastosowania nie tylko kulinarne
Jeżeli zabrakło ci kleju do papieru, możesz użyć białka. Zmieszaj je z niewielką ilością wody, posmaruj kartki i dociśnij. Po wyschnięciu klej dobrze trzyma (4). Nie śmiej się z tego zastosowania, białka mają właściwości klejące, w średniowieczu dodawano je do zaprawy murarskiej. Dowodem trwałości tak przygotowanych spoin są katedry, monumentalne budowle od wieków wzbudzające podziw w całej Europie. Klejące właściwości białka jaj wykorzystano oczywiście i w kuchni. Są one koniecznym dodatkiem do wypieków oraz potraw z mięsa mielonego, pełniąc w nich funkcję spoiwa. Smarowanie zaś białkiem powierzchni bułek drożdżowych przed wypiekiem zapewnia im ciemną, chrupiącą skórkę z charakterystycznym połyskiem. Przemiana zachodząca podczas pieczenia nosi nazwę reakcji Maillarda, a wiele produktów spożywczych zawdzięcza jej smak i zapach.
Białko jaja zawiera enzym o nazwie lizozym, który niszczy bakterie dostające się przez porowatą skorupkę (w warunkach naturalnych jaja znajdują się w środowisku dalekim od sterylności, stąd konieczność mycia ich przed użyciem w kuchni). Białka jaja możesz użyć na oparzoną lub podrażnioną skórę, co złagodzi ból, przyspieszy gojenie i zapewni jałowość. W warunkach polowych (np. biwak czy wycieczka) jako prowizoryczny plaster na ranę sprawdzi się błona z wewnętrznej strony skorupki.
Białkiem jaja wyczyścisz również przedmioty ze skóry. Wręcz przeciwnie działa ono natomiast na wyroby srebrne - te z kolei ciemnieją pod wpływem związków siarki zawartych zarówno w białku, jak i żółtku. Nie powinno być zatem zaskoczeniem, że srebrna czy też posrebrzana łyżeczka używana do jedzenia jajek na miękko po pewnym czasie pokryje się ciemnym nalotem. Efekt możesz wykorzystać celowo do nadania przedmiotowi ze srebra wiekowego wyglądu. Wystarczy powlec go ubitym na pianę białkiem lub nawet pomalować samym białkiem, aby pokrył się warstwą patyny (5).
ugotowanym na twardo (pojemnik przykryty folią). Po godzinie łyżeczka jest ciemnoszara
Najcenniejsza część…
…jaja to żółtko. Oprócz ogromnych wartości odżywczych, jego właściwości fizykochemiczne powodują, że jest szeroko używane w przemyśle spożywczym i domowej kuchni. Niech jednak informacje teoretyczne potwierdzi praktyka. Przygotuj słoik, nieco oleju roślinnego oraz żółtko jaja. To ostatnie możliwie starannie oddziel od białka (możesz pobrać próbkę ze środka żółtka). Do słoika wlej wodę i dodaj pół łyżeczki oleju. Ciekły tłuszcz nie miesza się z wodą i utworzy górną warstwę o żółtawym zabarwieniu. Do naczynia wlej teraz pół łyżeczki żółtka i dobrze wstrząśnij zawartością. Jeżeli żółtko zawierało domieszkę białka, na powierzchni utworzyła się piana. Spójrz na ciecz w słoiku: ma ona bladożółte zabarwienie, ale tworzy jednolity roztwór, bez oddzielnej warstwy oleju (6).
na powierzchni wody, po prawej jednolity roztwór po dodaniu żółtka i wymieszaniu
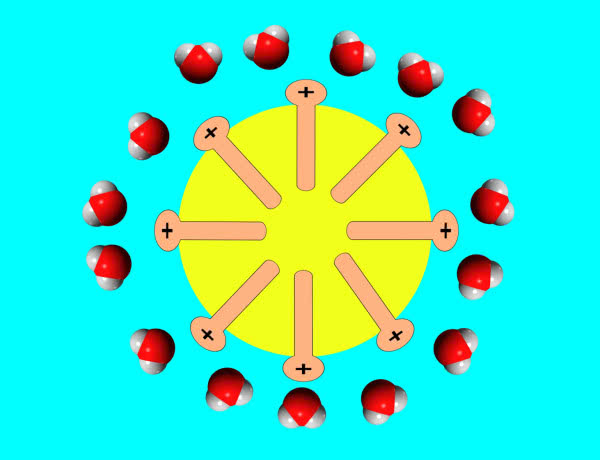
Zgodnie ze starym, jeszcze alchemicznym spostrzeżeniem similia similibus solvuntur (podobne rozpuszcza się w podobnym) niepolarny olej roślinny nie miesza się z wodą o polarnym charakterze W doświadczeniu żółtko jaja spełniło funkcję emulgatora i umożliwiło połączenie tłuszczu z wodą - żółtawy roztwór, który otrzymałeś po zmieszaniu, to emulsja typu O/W, czyli olej rozpuszczony w wodzie. Za takie działanie żółtka odpowiedzialny jest jego składnik o nazwie lecytyna. To pochodna zwykłych tłuszczów, mająca budowę podobną do…mydła. Działanie również jest analogiczne: niepolarna część cząsteczki wnika do tłuszczu, natomiast polarna skierowana jest w stronę wody. W efekcie kropelki oleju są rozproszone w całej objętości roztworu, a jednoimienny ładunek na powierzchni zapobiega ich połączeniu (7). W taki sposób żółtko jaja wykorzystywane jest do otrzymywania majonezu, lodów czy też kremów, czyli wszędzie tam, gdzie zachodzi konieczność połączenia tłuszczu z roztworem wodnym w jednolitą masę. Z kolei przykładem niekulinarnego zastosowania żółtka jest wykorzystanie go jako odżywki do włosów.
części polarne naładowane dodatnio wystają na zewnątrz i otaczają się molekułami wody
(w stronę lecytyny kieruje się atom tlenu, czyli ujemny koniec cząsteczki wody)
Jak zatem widzisz, nawet zwykłe jajko może stać się obiektem ciekawych i pouczających doświadczeń oraz wyjaśnić tajniki otaczającego świata. Nie będzie przesadą stwierdzenie, że chemik zawsze znajdzie coś interesującego ze swojej dziedziny.
Krzysztof Orliński