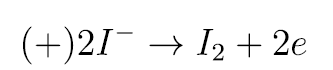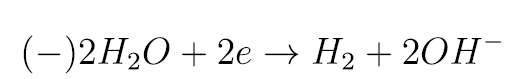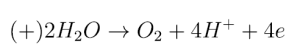Chemia na papierze - część 3. Prądem po papierze

Zanim zaczniesz eksperymenty, przygotuj niezbędne akcesoria, czyli przede wszystkim źródło prądu stałego. Jeżeli nie posiadasz zasilacza laboratoryjnego z prawdziwego zdarzenia, nie próbuj sam przerabiać zasilaczy np. do ładowania telefonów czy laptopów. Z prądem, nawet o niewielkim napięciu, nie ma żartów, a podłączenie urządzenia do sieci zawsze naraża cię na niebezpieczeństwo porażenia. Lepiej użyć zwykłych ogniw jednorazowych lub ładowalnych akumulatorów, które dla uzyskania większego napięcia połącz szeregowo („plus” jednego z „minusem” drugiego).
Pismo, a może nawet rysunek?
Przygotuj fragment stalowej blachy, starannie oczyść i odtłuść jej powierzchnię. Z kartki papieru do drukarki wytnij kawałek o rozmiarach nieco mniejszych od metalowej podkładki (po zmoczeniu bibuła jest mało wytrzymała mechanicznie). Kartkę zamocz w 10% wodnym roztworze jodku potasu KI z dodatkiem skrobi (mąki ziemniaczanej), połóż ją na blaszce, a całość umieść na tacy tak, aby uniknąć zalania blatu. Metal połącz z ujemnym biegunem źródła o napięciu 3…4,5 V (np. płaska bateria 6F22), natomiast do bieguna dodatniego przymocuj metalowy pręcik (część trzymaną w dłoni owiń taśmą izolacyjną). Gdy powoli zaczniesz przesuwać pręcikiem po papierze, na powierzchni pojawią się granatowe linie - możesz pisać lub rysować. Po wyschnięciu znaki pozostają na kartce.
Zmień kolor tuszu twojego „elektrycznego pióra”. Umyj i osusz metalową płytkę (po odłączeniu od prądu). Kolejną kartkę namocz w 10% wodnym roztworze siarczanu lub azotanu metalu lekkiego, np. Na2SO4 lub KNO3, z dodatkiem fenoloftaleiny. Zaciski baterii połącz z płytką i pręcikiem, tym razem zmieniając biegunowość: płytka z „plusem”, pręcik z „minusem”. Podczas pisania pojawią się czerwone znaki (1).
Elektroliza w akcji
Za barwne efekty odpowiada zjawisko elektrolizy, czyli - z greckiego - rozkładu substancji pod wpływem prądu elektrycznego. Nośniki ładunku, jony (dodatnie kationy i ujemne aniony), dążą do metalowych części połączonych z biegunami źródła - elektrod (ujemnej katody i dodatniej anody). W pierwszym doświadczeniu na anodzie rozładowywały się aniony jodkowe, a wydzielony wolny jod zabarwił na charakterystyczny kolor skrobię (symbol e oznacza elektron):
Dodatnie jony potasu K+ dążą do ujemnej katody, ale w warunkach doświadczenia nie mogą się na niej rozładować. W ich „zastępstwie” dochodzi do rozkładu wody:
Ostatnią reakcję wykorzystałeś w drugim doświadczeniu, gdzie powstające aniony wodorotlenkowe zmieniły odczyn okolic katody na zasadowy, a to z kolei skutkuje czerwonym zabarwieniem fenoloftaleiny. Ponieważ żaden z jonów powstających w wyniku dysocjacji soli nie ulega rozładowaniu przy stosowanym przez ciebie niskim napięciu, na elektrodzie dodatniej również rozkłada się woda (okolice anody są zakwaszone):
Jaki to biegun?
Reakcje zachodzące w pobliżu elektrod możesz wykorzystać do określenia biegunowości źródła napięcia prądu stałego (lub po prostu wykonać kolejne doświadczenia z ciekawymi efektami wizualnymi). Bieguny źródła o napięciu 3…4,5 V połącz z oczyszczonymi z nalotów gwoździami lub grafitowymi pałeczkami wyjętymi z ogniw jednorazowych (z oznaczeniem na obudowie zaczynającym się od litery R). Wytnij paski z bibuły i nasącz je roztworami (nie muszę przypominać, że całość umieszczasz na tacy).
Zacznij od wykonania roztworu Na2SO4 lub KNO3 z dodatkiem wskaźnika błękitu bromotymolowego i zanurz w nim pasek bibuły. Gdy na pasku umieścisz obie elektrody (w odległości kilku centymetrów od siebie), wokół nich zaczną powstawać barwne plamy: żółta i niebieska (wskaźnik w roztworze o odczynie obojętnym przybiera zielony kolor). Wokół obu elektrod dochodzi do rozkładu wody według równań zapisanych wyżej. Czy już wiesz, jakie znaki mają bieguny źródła (2)?
Powtórz doświadczenie, jako wskaźnika używając oranżu metylowego. Tym razem barwna plama pojawia się tylko wokół jednej elektrody. Eksperyment możesz zmodyfikować, stosując dostępne ci wskaźniki pH, gotowe papierki uniwersalne (te nasączasz tylko roztworem jednej z podanych soli), a nawet sok z czerwonej kapusty (czerwony w środowisku o odczynie kwasowym i zielony w alkalicznym) (3).
Zabarwienie papierka wskaźnikowego pozwala
jednoznacznie określić znaki elektrod
Jeszcze jedno dwukolorowe doświadczenie. Do roztworu jodku potasu KI z dodatkiem skrobi dodaj kilka kropli roztworu fenoloftaleiny i mieszaniną nasącz pasek bibuły. Kolorowe plamy, znane ci już z pisania „elektrycznym piórem”, powstają wokół każdego z gwoździ. I w tym przypadku zapewne nie będzie trudności w określeniu znaków elektrod (4).
pozwolą określić znaki biegunów źródła prądu stałego
W służbie analizy chemicznej
Elektroliza z użyciem bibuły nasyconej odpowiednio dobranym roztworem jest również ciekawą metodą analityczną służącą do identyfikowania nawet mikroskopijnych ilości danej substancji. Stosowana aparatura jest identyczna z przypadkiem „elektrolitycznego pisma” z użyciem jodku potasu: metalowa płytka przyłączona do ujemnego bieguna źródła,
na niej bibuła nasycona roztworem elektrolitu, biegun dodatni połączony z metalowym pręcikiem (5).
Zmontuj zestaw jak w pierwszym eksperymencie, bibułę nasącz roztworem chlorku sodu NaCl z dodatkiem heksacyjanożelazianu(II) potasu K4[Fe(CN)6] (żelazocyjanek potasu). Stężenia obu odczynników wynoszą 3…5%. Uważaj, aby elektrolit nie wyciekał z bibuły, wystarczy, że podłoże jest tylko wilgotne. Podłącz zaciski źródła napięcia do płytki i pręcika, na bibule połóż oczyszczoną z nalotów miedzianą blaszkę i przyciśnij ją pręcikiem. Po minucie odłącz prąd i zdejmij
blaszkę. Pod spodem zauważysz brunatną plamę Cu2[Fe(CN)6], co jest jedną z charakterystycznych prób pozwalających wykryć obecność jonów miedzi(II) w roztworze. Ale skąd one się tam wzięły?
Metal podłączony do dodatniego bieguna źródła oddaje elektrony i w postaci jonów dodatnich przechodzi do roztworu - mówimy, że ma miejsce utlenianie anodowe (anoda podczas elektrolizy jest dodatnia). Uwolnione kationy metalu reagują następnie z odpowiednio dobranym odczynnikiem (u ciebie był to żelazocyjanek potasu), najczęściej dającym z nimi barwny
produkt. Jak być może wiesz, chlorki przyspieszają korozję metali, stąd ich dodatek do elektrolitu nasycającego bibułę. Prawda, że sposób jest prosty?
Nazwa metody to elektrografia, czyli - znowu z greckiego - „pisanie prądem”. Analiza elektrograficzna nadaje się szczególnie do badania stopów metali. Jej zalety to: prosta aparatura, umożliwiająca przeprowadzanie prób poza wyspecjalizowanym laboratorium (np. na miejscu przestępstwa), minimalne ilości użytych chemikaliów (co przekłada się na niski koszt analizy) i krótki czas uzyskania wyników. Dodatkowo badanie elektrograficzne jest nieniszczące (roztworzeniu ulega jedynie niemożliwa do zauważenia powierzchniowa warstwa przedmiotu stykająca się z bibułą), dzięki czemu metodę stosuje się do badania przedmiotów o wartości muzealnej lub dowodów przestępstwa (można np. stwierdzić obecność śladów metalu na obrzeżach ran). Działanie prądu o napięciu kilku woltów i natężeniu kilku miliamperów przez krótki czas nie powoduje ujemnych skutków zdrowotnych, analiza może być także wykonywana bezpośrednio na żywym organizmie (elektrodą ujemną dotyka się ciała w pobliżu badanego miejsca).
Powtórz doświadczenie i spróbuj wykryć obecność miedzi w mosiądzu (stop z cynkiem) czy też w stopach użytych do produkcji monet.
Jak zapewne się domyślasz, za pomocą elektrografii możesz stwierdzić również obecność innych metali w stopach, wystarczy tylko znaleźć odczynnik dający charakterystyczną reakcję z danym kationem. Zacznij od ołowiu. Taśmę ołowianą lub ciężarek wędkarski oczyść z ciemnego powierzchniowego nalotu. Jako odczynnika do identyfikacji jonów ołowiu(II) użyj 1…2% roztworu chromianu(VI) potasu K2CrO4 z niewielkim dodatkiem kwasu octowego CH3COOH (zwykłego octu). Ponieważ sam roztwór chromianu ma barwę żółtą, wymagane jest niewielkie stężenie tej soli, inaczej trudno zaobserwować barwny efekt reakcji. Po przerwaniu przepływu prądu pod taśmą widoczny jest ciemnożółty ślad osadu chromianu ołowiu. Inną charakterystyczną reakcją jonów Pb2+ jest powstawanie złocistego jodku PbI2. Jednak, jak
już się przekonałeś, równocześnie na anodzie rozładowują się jony jodkowe, co powoduje powstanie brunatnych plam wolnego jodu (ze skrobią są one granatowe). Próba da jednak pozytywny wynik, jeżeli w elektrolicie znajdzie się również dodatek tiosiarczanu sodu Na2S2O3, który reaguje z wolnym jodem, redukując go do bezbarwnych jonów jodkowych. Innym rozwiązaniem jest użycie elektrolitu zawierającego jedynie sam ocet lub chlorek sodu. Po odłączeniu zasilania miejsce pod próbką ołowiu zwilż roztworem jodku potasu, co powinno ujawnić złocistą plamę. W ten sposób wywołasz otrzymany elektrogram, zupełnie jak fotografię (6).
W stopach monetowych częstym dodatkiem jest nikiel, np. w bilonie o nominałach 10, 20 i 50 gr oraz 1 zł. Do jego wykrycia potrzebny jest jednak specyficzny odczynnik: dimetyloglioksym (odczynnik Czugajewa) w postaci 1% roztworu alkoholowego. Jeżeli go masz, sporządź 3…5% roztwór NaCl z dodatkiem niewielkiej ilości roztworu dimetyloglioksymu.
Gdyby po zakończeniu próby nie powstała różowa plama w miejscu umieszczenia monety, zwilż powierzchnię bibuły roztworem amoniaku.
Znacznie łatwiej przyjdzie ci oznaczyć żelazo w dowolnym przedmiocie stalowym. Ponieważ w wyniku utleniania anodowego powstają głównie jony Fe2+, jako elektrolitu użyj 5% roztworu heksacyjanożelazianu(III) potasu K3[Fe(CN)6] (żelazicyjanek potasu, nie pomyl go z odczynnikiem do wykrywania miedzi) z niewielkim dodatkiem kwasu octowego i chlorku sodu. Po zakończeniu próby wyraźnie widać niebieski ślad o kształcie zbliżonym do przedmiotu leżącego na bibule
- jest to osad barwnika błękitu pruskiego (7).
Z kolei do identyfikacji srebra, np. w platerowanej łyżeczce, możesz użyć elektrolitu stosowanego w przypadku ołowiu (K2CrO4 + ocet), co spowoduje powstanie brunatnej plamy chromianu srebra. Dobre wyniki daje również zastosowanie roztworu chlorku sodu. W tym przypadku po zakończeniu próby i wystawieniu bibuły na światło pojawi się ciemna plama metalicznego srebra powstała z rozłożonego AgCl (8).
Jak więc widzisz: prąd + papier = ciekawe eksperymenty.
Krzysztof Orliński
Zobacz także:
Chemia na papierze - część 1. Obrazy, które same się malują
Chemia na papierze - część 2. Pisanie barwą