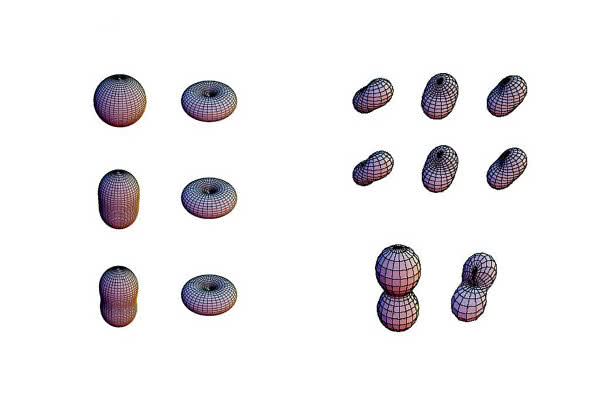Atom - znów widzimy go inaczej. Między morzem kwarkowym a elektronowymi obłokami

Spójrzmy na atom inaczej. Pozostaje on wciąż najmniejszą znaną nam jednostką materii, która zachowuje cechy makroskopowego świata, takie jak właściwości fizyczne i chemiczne. Schodząc niżej, do kwarków i leptonów, już nie widać (nie widać, co nie znaczy, że go nie ma) związku z np. konkretnym pierwiastkiem lub związkiem chemicznym, jego cechami jak masa atomowa np. Poniżej skali atomu jest świat rządzący się już innymi, nie zawsze dla nas jasnymi regułami.
A może nam się tylko wydaje, bo w końcu fakt, że powstają i istnieją takie, a nie inne atomy, musi z czegoś, co jest mniejsze i bardziej podstawowe, wynikać. Jeśli określona liczba protonów i neutronów związana w jądrze to osnowa pierwiastka o określonych właściwościach, to zjawiska, które spowodowały połączenie tych cząstek, interakcje kwarków i antykwarków, leptonów i ich antyodpowiedników z cząstkami pośredniczącymi muszą mieć związek z wyższym poziomem atomowym, tak jak on rzutuje na poziom makroskopowy.
Atom to nie budyń śliwkowy
Idea atomu sięga aż starożytnego greckiego filozofa Demokryta około 400 roku p.n.e. Demokryt był jednym z pierwszych deterministów, twierdzącym, że świat zbudowany tylko z atomów i kontrolowany przez prawa fizyki nie pozostawia miejsca na wolną wolę. Doprowadziło to do jego "teorii eidôli", aby wyjaśnić, w jaki sposób nasze umysły tworzą iluzję rzeczywistości.
Chociaż idea "atomu" krążyła po Grecji już wcześniej, Demokryt był pierwszym uczonym, który w pełni ją wyraził. Twierdził, że atomy muszą istnieć, ponieważ alternatywa jest czystym nonsensem. Gdybyśmy mogli nieustannie dzielić lub rozcinać rzeczy na dwie części, trwałoby to wiecznie. Wszechświat, jak twierdził, nie może być zbudowany bez fundamentów. Tak więc musi istnieć fundamentalna jednostka świata, z której wszystko inne jest zbudowane, i dla niej właśnie Demokryt ukuł termin "atom" (co dosłownie oznacza coś nie do przecięcia).
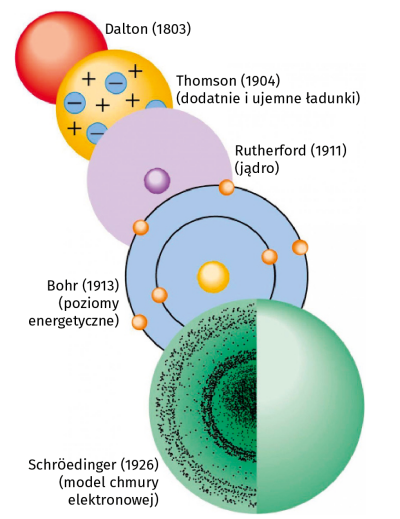
Wieki po Demokrycie, ok. 1800 roku John Dalton uznał, że pierwiastki zbudowane są z małych drobin zwanych atomami, przy czym atomy nie mogą być podzielone, zmienione lub zniszczone za pomocą środków chemicznych, atomy danego pierwiastka są wszystkie takie same pod względem kształtu i wielkości, a atomy różnych pierwiastków różnią się wielkością i kształtem, pierwiastki charakteryzują się masą swoich atomów, więc wszystkie atomy danego pierwiastka mają identyczną masę. Atomy różnych pierwiastków mogą łączyć się ze sobą, tworząc związki chemiczne. Jednak John Dalton błędnie postulował, że gdy atomy łączą się niejako w równych ilościach. Otrzymał wzory wody jako HO i amoniaku jako NH.
Do 1897 roku uważano, że atomy są najmniejszym możliwym podziałem materii. Jednak J.J. Thompson w serii eksperymentów na promieniach katodowych odkrył elektron. Przy okazji obalił tezę, że atomy są niepodzielne, jak proponowali starożytni Grecy i Dalton. Doprowadziło to do odkrycia cząstek subatomowych. Thomson twierdził, że elektrony poruszają się losowo w morzu równomiernie rozłożonych ładunków dodatnich, aby wytłumaczyć neutralny ładunek atomu, jak śliwki w budyniu śliwkowym. Model ten nazywany jest "modelem budyniu śliwkowego".
Model oparty na tym deserze został obalony przez eksperyment przeprowadzony przez Hansa Geigera i Ernesta Marsdena (eksperyment Geigera-Marsdena) pracujących na zlecenie Ernesta Rutherforda pod koniec pierwszej dekady XX wieku.
Doprowadziło to do opracowania jądrowego modelu budowy atomu. Rutherford doszedł do wniosku, że dodatni ładunek atomu musi być skoncentrowany w bardzo małej objętości, aby wytworzyć pole elektryczne o wystarczającej sile do odpychania cząstek alfa. W 1911 roku Rutherford zaproponował następujący model atomu z jądrem: dodatni ładunek atomu jest skoncentrowany w jądrze, które, jak zakładano, znajduje się w centrum, chmury elektronów krążą wokół jądra, większość objętości atomu leży pomiędzy maleńkim jądrem a chmurą elektronów, atom nie ma ładunku netto, ponieważ ładunki dodatnie i ujemne znoszą się wzajemnie.
Model ten uzupełniony został przez Henry’ego Moseleya ok. 1913 roku. Przed Moseleyem liczba atomowa pierwiastków była arbitralną liczbą przypisywaną przez naukowców w celu uporządkowania pierwiastków w układzie okresowym. Moseley wykorzystał technikę zwaną spektroskopią rentgenowską do ustalenia matematycznego związku pomiędzy liczbą atomową pierwiastków a długością fali promieniowania rentgenowskiego. Praca Moseleya na nowo zdefiniowała liczbę atomową jako wartość, która może być użyta do uporządkowania pierwiastków w układzie okresowym. Moseley rozumiał liczbę atomową jako dokładną liczbę dodatnich ładunków (później uznanych przez Ernesta Rutherforda za protony) w jądrze atomu.
Już wtedy Niels Bohr proponował swój model atomu, który opierał się na mechanice kwantowej postulowanej przez Alberta Einsteina i Maxa Plancka. Zakłada się w nim, że energia świetlna jest emitowana lub absorbowana w dyskretnych ilościach zwanych kwantami. Jego model pozwala elektronom podążać pewnymi ścieżkami o określonej energii wokół jądra. Zgodnie z tym modelem elektrony w powłokach nie mogły tracić energii i mogły jedynie przeskakiwać z jednego poziomu energetycznego na drugi.
Kiedy tak się działo, światło było emitowane lub absorbowane z częstotliwością proporcjonalną do różnicy energii pomiędzy powłokami. Model budowy atomu Bohra pomógł wyjaśnić niektóre własności okresowe, takie jak linie widmowe widoczne w widmach emisyjnych oraz energię elektronów w różnych odległościach od jądra.
W 1924 Louis de Broglie zasugerował, że zachowanie elektronów może być wyjaśnione zarówno w kategoriach fali, jak i cząstki. W 1926 roku Erwin Schrödinger opisał elektron jako cząstkę falową w postaci równania Schrödingera. Równanie to było trudne do zwizualizowania i Max Born pogodził przeciwstawne idee opisania elektronu jako fali i cząstki, wprowadzając teorię dualizmu korpuskularno-falowego. To on jest twórcą idei, że równanie Schrödingera opisuje położenie elektronów w atomie w kategoriach prawdopodobieństwa. Unieważniło to koncepcję modelu Bohra, który miał jasno zdefiniowane drogi elektronów na kolistych orbitach (3).
Dopełnieniem tych wysiłków naukowych było odkrycie Jamesa Chadwicka w 1932 roku neutronów, choć było to raczej potwierdzenie wcześniejszej hipotezy Rutherforda z 1918 roku, gdy odkrył on protony. Masa neutronów i protonów są prawie jednakowe a obie cząstki są ponad 1,8 tysiąca razy masywniejsze od elektronu. Zatem protony i neutrony stanowią większość masy atomów.
Kilka dekad później okazało się, że da się zejść głębiej w budowę cząstek. Po odkryciu kwarków wewnątrz protonów i neutronów na początku lat 70., niektórzy teoretycy sugerowali, że kwarki mogą same zawierać jeszcze mniejsze cząstki znane jako "preony". Pomysł ten nie miał podstaw w danych eksperymentalnych, ale nieco z rozpędu, skoro odkryto mniejsze rzeczy niż cząstki elementarne, można go uznać za dopuszczalny. Obecnie wielu fizyków uważa, że kwarki, elektrony i wszystkie inne cząstki najlepiej opisać jako wibracje "superstrun", wielowymiarowych bytów znacznie mniejszych niż najmniejsza cząstka subatomowa.
Coś przyciąga, coś odpycha, coś jest dodatnie, a coś ujemne
Na Ziemi istnieje dziewięćdziesiąt pierwiastków, które występują naturalnie jako pozostałość po procesach kosmicznych, które, według naszej wiedzy, doprowadziły do ich powstania. Pierwiastek można sprowadzić do atomu, z jądrem atomowym zbudowanym z protonów i (ewentualnie) neutronów, wokół którego krąży liczba elektronów równa liczbie protonów. Każdy pierwiastek ma swój własny, unikatowy zestaw właściwości, a wśród nich: określoną twardość, barwę, temperaturę topnienia i wrzenia, gęstość, przewodnictwo elektryczne (parametr określający łatwość transportu elektronów po przyłożeniu napięcia), elektroujemność (miara tendencji do przyciągania elektronów przez atomy danego pierwiastka, gdy tworzy on związek chemiczny z atomami innego pierwiastka), energia jonizacji (jak dużo energii potrzeba do wybicia elektronu z atomu) i wiele innych.
Natomiast jest tylko jeden parametr, który określa typ atomu (a w konsekwencji całą wymieniona wyżej gamę właściwości pierwiastków) - liczba protonów w jądrze. Każdy atom danego pierwiastka, z określoną, definiującą go liczbą protonów w jądrze, będzie tworzył specyficzny zestaw wiązań z innymi atomami, umożliwiając powstawanie nieograniczonej praktycznie liczby cząsteczek chemicznych i większych struktur.
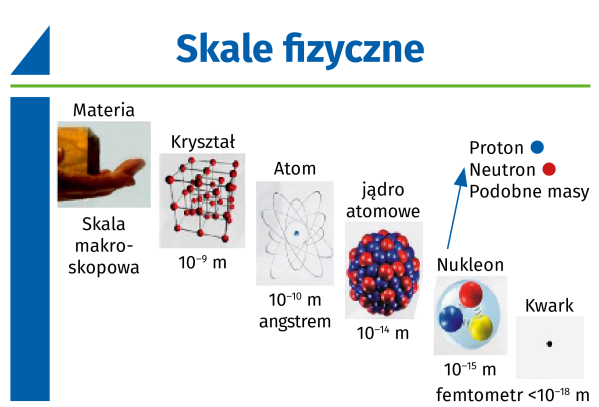
Atomy mają wspólną cechę - masę. Im więcej protonów i neutronów w jądrze atomowym, tym bardziej masywny jest atom. Mimo że są to zjawiska kwantowe, a pojedynczy atom ma średnicę nie większą niż jeden angstrem, zasięg działania wynikającej z istnienia masy siły grawitacji nie jest ograniczony. Każdy obiekt mający masę zakrzywia strukturę czasoprzestrzeni zgodnie z ogólną teorią względności Einsteina. Bez względu na to, jak mała jest masa lub jak małe są skale odległości, które rozpatrujemy. Zakrzywienie przestrzeni wywoływane jest przez każdą liczbę atomów, czy będzie ich ~1057 (tak jak w gwieździe), czy ~1028 (jak w człowieku), czy tylko jeden.
Zarazem atomy składają się z cząstek naładowanych elektrycznie. Protony mają dodatni ładunek elektryczny, neutrony są elektrycznie neutralne, elektrony zaś mają ładunek równy i przeciwny protonom. Wszystkie protony i neutrony są związane razem w jądrze atomowym o średnicy zaledwie femtometra (~10-15 m), natomiast elektrony znajdują się w chmurze, która ma rozmiar mniej więcej sto tysięcy razy większy od jądra.
Każdy elektron zajmuje swój własny poziom energetyczny i może zmienić tylko na inny ściśle określony, żadne inne przejścia nie są dozwolone. Jest to godne uwagi z różnych względów. Z jednej strony, kiedy atom znajdzie się w pobliżu innego atomu (lub grupy atomów), mogą one oddziaływać na siebie. Na poziomie kwantowym ich funkcje falowe mogą się nakładać, pozwalając atomom łączyć się w cząsteczki, tworząc np. jony lub sole. Te związane struktury mają swoje własne kształty i konfiguracje chmur elektronowych. Mają one również swoje własne poziomy energetyczne, które absorbują i emitują fotony (cząsteczki światła) tylko o określonej długości fali.
Poziomy elektronowe w atomie lub grupie atomów są wyjątkowe i charakterystyczne dla danego atomu lub konfiguracji grupy wielu atomów. Gdy badamy wzory linii widmowych atomu lub molekuły, to nie ma znaczenia, czy są to linie emisyjne, czy absorpcyjne, natychmiast zdradzają one, jaki typ atomu lub molekuły obserwujemy. Wewnętrzne przejścia elektronów dają unikatowy zestaw poziomów energetycznych, a przejścia tych elektronów ujawniają jednoznacznie, o jaki typ i konfigurację atomu(ów) chodzi.
W każdym miejscu w znanym nam Wszechświecie atomy i cząsteczki przestrzegają tych samych zasad, praw klasycznej i kwantowej elektrodynamiki, które rządzą każdą naładowaną cząstką we Wszechświecie. Nawet wewnątrz samego jądra atomowego, które jest wewnętrznie złożone z naładowanych kwarków i nienaładowanych gluonów, siły elektromagnetyczne pomiędzy tymi naładowanymi cząstkami są niezwykle ważne. Ta wewnętrzna struktura wyjaśnia, dlaczego moment magnetyczny protonu jest prawie trzy razy większy od momentu magnetycznego elektronu (ale przeciwnego znaku), podczas gdy neutron ma moment magnetyczny prawie dwa razy większy od elektronu, ale tego samego znaku.
Oddziaływanie elektromagnetyczne, choć ma zasięg podobnie jak grawitacja nieskończony, to jest nieporównanie potężniejsze. Dwa protony odpychają się od siebie z siłą ~1036 razy większą, niż wynosi ich przyciąganie grawitacyjne, bo jako obdarzone masą oczywiście się przyciągają. To dlaczego protony gromadzą się w jądrze pomimo tej odpychającej potęgi? Oczywiście jest kolejna siła, jeszcze potężniejsza, która je wiąże.
Gdy schodzimy do skali femtometrowej, po raz pierwszy zaczynamy dostrzegać efekty silnego oddziaływania jądrowego. Pojawia się pomiędzy różnymi nukleonami - protonami i neutronami, które tworzą każde jądro atomowe. Tak naprawdę oddziaływanie silne występuje pomiędzy kwarkami przez wymianę gluonów. Związane struktury par kwark-antykwark, znane jako mezony, mogą być wymieniane pomiędzy różnymi protonami i neutronami, wiążąc je w jądro i, jeśli konfiguracja jest odpowiednia, pokonują odpychającą siłę elektromagnetyczną. Silne oddziaływania jądrowe zachodzą tylko na bardzo małych odległościach rzędu 10-15 m. Z powodu tego właśnie limitu pierwiastki o większych jądrach, powyżej 92, są niestabilne.
Oprócz ładunków grawitacyjnych (masowych) i elektromagnetycznych (elektrycznych), które ma materia, istnieje jeszcze pewien rodzaj ładunku charakterystyczny dla kwarków i gluonów - ładunek kolorowy. Ładunek kolorowy cząstek złożonych z kwarków wynosi 0, a zatem wypadkowy ładunek kolorowy cząstki musi być równy zeru. Inaczej mówiąc, cząstki mające ładunek kolorowy nie mogą występować w przyrodzie samodzielnie. Bariony (np. proton i neutron) składają się z trzech kwarków o różnych kolorach, a mezony z kwarka, mającego określony kolor, i antykwarka, mającego odpowiadający mu antykolor. Dzięki temu bariony i mezony są kolorowo obojętne (bezbarwne). Teoria oddziaływań związanych z ładunkiem kolorowym nosi nazwę chromodynamiki kwantowej.
Wymiana gluonów, szczególnie gdy kwarki oddalają się od siebie (wtedy oddziaływanie staje się silniejsze), jest tym, co trzyma w ryzach protony i neutrony. Im wyższa energia, z jaką rozbijamy coś w tych subatomowych cząstkach, tym więcej kwarków (i antykwarków) oraz gluonów możemy efektywnie zobaczyć. To tak, jakby wnętrze protonu było wypełnione morzem cząstek, a im mocniej rozbijamy, tym bardziej "lepkie" się stają. Gdy schodzimy w najgłębsze, najbardziej energetyczne rejony, jakie kiedykolwiek badaliśmy, nie widzimy żadnych ograniczeń gęstości tych subatomowych cząstek wewnątrz każdego jądra atomowego. Proton to nie tylko trzy kwarki i gluony, ale całe morze gęstych cząstek i antycząstek (4).
Jak wspominaliśmy, wiele atomów jest niestabilnych. Może nastąpić rozpad radioaktywny, co oznacza, że w końcu wyrzucą cząstkę (lub zestaw cząstek), co zmienia typ atomu. Najczęstszym typem rozpadu radioaktywnego jest rozpad alfa, w którym niestabilny atom wyrzuca po dwa protony i neutrony. Drugim najczęstszym typem rozpadu jest rozpad beta, w którym atom wysyła elektron i neutrino antyelektronowe, a jeden z neutronów w jądrze przekształca się w proton.
Wyjaśnienie tych zjawisk wymaga jeszcze jednego oddziaływania - słabego jądrowego. Siła oddziaływania słabego jest 109 razy mniejsza niż siła oddziaływania silnego. Jest zbyt słabe, by połączyć leptony w większe cząstki, tak jak oddziaływania silne łączą w hadronach kwarki. Słaby ładunek okazał się niezwykle trudny do zmierzenia, ponieważ oddziaływanie słabe jest miliony razy mniejsze niż silne czy elektromagnetyczne, aż do momentu, gdy zejdziemy do niezwykle małych odległości, takich jak 0,1 proc. średnicy protonu. W odpowiednim atomie, niestabilnym wskutek rozpadu beta, oddziaływanie słabe może być widoczne, co oznacza, że w atomie widać wszystkie cztery podstawowe siły.
Cztery fundamentalne oddziaływania można ująć krótko w ten sposób: silne utrzymuje w całości jądro atomowe, elektromagnetyczne - cały atom, grawitacja - obiekty kosmiczne, zaś słabe działa w rozpadzie radioaktywnym.
Elektron istnieje jako prawdopodobieństwo
Nasze postrzeganie atomów zmieniło się diametralnie w ciągu ostatnich stu lat. Od eksperymentów Rutherforda nad jądrem po odkrycia dotyczące neutronów, udało nam się prześwietlić naturę fundamentalnego budulca Wszechświata. Jest także pewna tradycja myślenia o atomach w tej sposób, że są w większości puste ze względu na ogromne dysproporcje rozmiarów jądra i elektronów i ich odległości od jądra. Jednak ten obraz jest błędny, głównie dlatego, że elektrony nie są cząstkami o charakterze punktowym. Nie są też "obłoczkami" czy "mgiełkami", jak to również bywa wyobrażane. Ich opis jest bardziej skomplikowany.
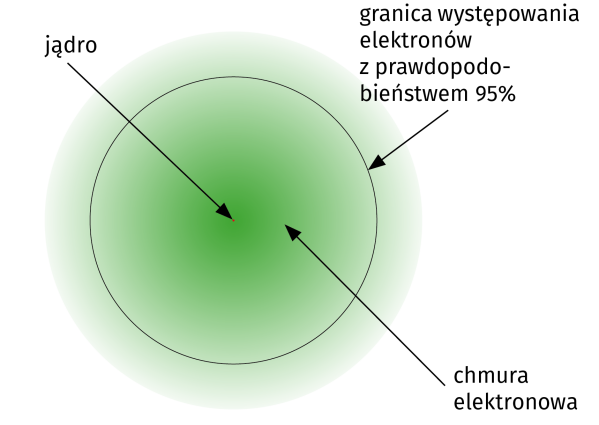
Opisuje je kwantowa funkcja falowa, która jest skomplikowanym sposobem przekazania, że istnieją one jako pola prawdopodobieństwa (5), a nie jako pojedyncze cząstki. Powiedzmy, że mamy elektron sam w sobie, bez atomów w pobliżu lub sił elektromagnetycznych działających na niego. Im dalej od tego punktu, tym prawdopodobieństwo, że elektron się tam znajdzie, jest mniejsze, spada w tempie wykładniczym.
Szybkość, z jaką to prawdopodobieństwo maleje, im dalej się znajdujemy, jest znana jako kwantowa funkcja falowa cząstki. Oznacza to, że istnieje bardzo, bardzo mała szansa, że elektron może zniknąć w tym miejscu i natychmiast pojawić się ponownie po drugiej stronie Wszechświata. Szanse te są jednak tak małe, że praktycznie nigdy się to nie zdarzy. Można by też powiedzieć, że elektron ciągle znika i pojawia się ponownie, tworząc wspomniane pole prawdopodobieństwa (opisywane często jako chmura elektronowa - nie mylić z chmurą elektronów, bo to nie to).
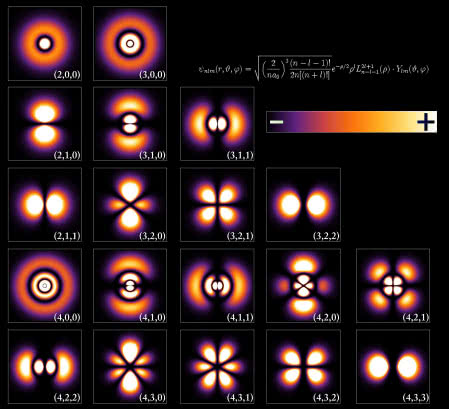
Dla tych, którzy nie pamiętają, atomy mają różne energetyczne "powłoki", w których elektrony miały, wedle starszych wyobrażeń, orbitować. Zgodnie z tym modelem, jeśli atomy otrzymywałyby więcej energii, wtedy elektrony orbitowałyby w zewnętrznych "powłokach" o wyższej energii. Jeśli jednak elektrony nie mają ustalonej odległości orbitalnej, to nie można mówić o różnych powłokach energetycznych w atomie. W najnowszych modelach wygląda to nieco inaczej. Owe "powłoki" są nie tyle koncentrycznymi sferami o kolejno rosnącej średnicy, ale złożonymi wzorami "chmur" elektronowych lub raczej pól prawdopodobieństwa. Te oddziałują ze sobą, a to tworzy wiele pięknych, zadziwiających wręcz kształtów (6). Chociaż są to symulacje, a nie obrazy, pokazują one dziwną, bąbelkowatą i rozmytą naturę atomów. Różne kwantowe funkcje falowe elektronów mogą harmonizować ze sobą, ponieważ różne elektrony przyjmują więcej energii i zmieniają swoją funkcję falową. Oznacza to, że zwykły relatywnie mały atom, taki jak wodoru, może wykazywać bogactwo wzorów "chmur" elektronowych, w zależności od poziomów energetycznych, co zmienia "wygląd" atomu na rozliczne sposoby.
Owe obłoki i pola prawdopodobieństwa stanowią jedno z wyjaśnień, dlaczego, choć atomy są dziesiątki tysięcy razy większe niż rozmiary cząstek, materia na ogół nie jest przezroczysta i nie da się w nią łatwo wniknąć, a wręcz przeciwnie - stawia zwykle silny opór. Zarówno bowiem cząstki światła, fotony, jak i atomy materii tylko w niektórych okolicznościach mogą "przejść" bez interakcji z cząstkami czy całymi atomami.
Atomy łączą się ze sobą, aby ich układ ujemnie naładowanych elektronów był bardziej stabilny. Każda "powłoka" staje się stabilna, gdy zawiera pewną liczbę elektronów. Tak wynika z teorii kwantowej. Wiązanie pozwala atomom osiągnąć tę stabilność poprzez wymianę lub dzielenie się elektronami z innymi atomami, aż do momentu, gdy każdy z nich wypełni swoją powłokę. Tak więc, na przykład, atomy sodu i chloru łączą się, ponieważ zewnętrzna powłoka sodu może stać się stabilna poprzez utratę elektronu, podczas gdy ten ostatni może to zrobić poprzez zyskanie elektronu.
Te dwa atomy trzymają się razem, ponieważ utrata elektronu powoduje, że atom sodu jest naładowany dodatnio, a uzyskanie elektronu powoduje, że atom chloru jest naładowany ujemnie - a przeciwne ładunki się przyciągają. Jest to znane jako "wiązanie jonowe". Innym sposobem wiązania jest dzielenie się elektronami, czyli "wiązanie kowalencyjne". Na przykład, atomy tlenu potrzebują dwóch dodatkowych elektronów, aby ich powłoki zewnętrzne stały się stabilne, i mogą to osiągnąć, dzieląc dwa elektrony z innym atomem tlenu. Dzięki temu oba atomy stają się stabilne, a powstałe w ten sposób wiązanie tworzy cząsteczkę tlenu.
Jeśli już omawiamy wyobrażone kształty składników atomu - zwykle myślimy o elektronach, protonach i innych cząstkach jako o obiektach idealnie kulistych, przypominających małe kuleczki. Gdy w przypadku elektronów wydaje się to całkiem dokładne, najnowsze badania nad protonami ujawniły, że nieustannie zmieniają one swój kształt.
Wystrzeliwując w nie cząstki i analizując ich trajektorie, fizycy odkryli, że na kształt protonów wpływa prędkość kwarków w ich wnętrzu. Protony mogą zatem przybierać kształty, takie jak: obwarzanka - powodowanego przez najszybsze kwarki, wirujące w przeciwnym kierunku niż proton, orzeszka ziemnego - wytwarzane przez najszybsze kwarki, wirujące w tym samym kierunku co proton, piłki do rugby - wytwarzane przez kwarki, które poruszają się wolniej, i w końcu kuli - tworzonej przez najwolniejsze kwarki (7).
Co jest głębiej? Symetrie, kubity czy hologramy?
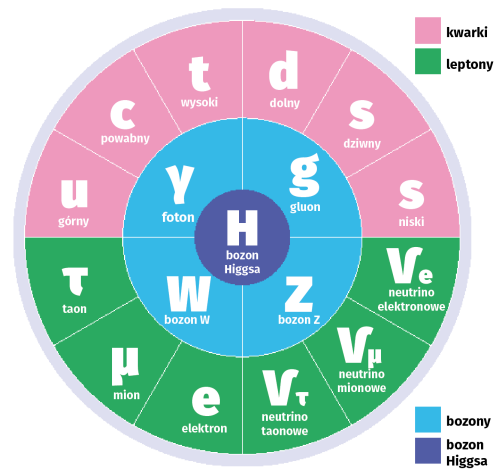
Wracając do schodzenia w głąb struktury atomu, należy przypomnieć, że wciąż obowiązujący, ale coraz zacieklej atakowany Model Standardowy fizyki (8) dzieli fermiony, cząstki budujące materię na kwarki i leptony (bozony i cząstka Higgsa są czymś innym - przenoszą oddziaływania).
Kwarki i leptopy na razie nie mają podstruktury. "W zasadzie myślimy o takiej cząstce jako o obiekcie punktowym," wyjaśnia w swoich pracach Mary Gaillard, fizyk z Uniwersytetu Kalifornijskiego w Berkeley, która w latach 70. przewidziała masę dwóch rodzajów kwarków. A przecież cząstki mają odrębne cechy, takie jak ładunek i masa. Jak bezwymiarowe punkty mogą mieć różniącą się masę?
W przypadku każdego innego obiektu jego właściwości zależą od jego fizycznego składu, a ostatecznie od jego części składowych. Jednak, według naszego obecnego stanu wiedzy, właściwości tych cząstek nie wynikają z ich składników, lecz z matematycznych wzorów.
Mechanika kwantowa dowodzi, że fotony i inne obiekty kwantowe najlepiej opisywać nie jako cząstki czy fale, ale przez abstrakcyjne "funkcje falowe", które wskazują prawdopodobieństwo posiadania przez cząstkę właściwości. Jak piszemy wyżej, funkcja falowa reprezentująca np. elektron jest przestrzennie rozłożona, tak że elektron ma raczej możliwe lokalizacje niż jedną określoną.
Jednak w jakiś dziwny sposób, gdy weźmiemy detektor i zmierzymy położenie elektronu, jego funkcja falowa nagle "zwija się" w określony punkt. Cząstka jest więc wówczas kolapsem funkcji falowej. Ale co to w ogóle znaczy? Dlaczego obserwacja powoduje, że rozciągnięta funkcja matematyczna zapada się i pojawia się konkretna cząstka? I co decyduje o wyniku pomiaru?
Sto lat po pierwszych kwantowych eksperymentach fizycy nie mają pojęcia
Z upływem czasu robiło się coraz dziwniej. W latach 30. XX wieku fizycy zdali sobie sprawę, że funkcje falowe wielu pojedynczych fotonów zachowują się jak jedna fala rozchodząca się w połączonych polach elektrycznym i magnetycznym, zgodnie w przewidywaniami Jamesa Clerka Maxwella. Naukowcy odkryli, że mogą "skwantować" klasyczną teorię pola, ograniczają je do określonych porcji. Paul Dirac i inni odkryli, że pomysł ten można ekstrapolować z fotonów na elektrony i inne cząstki. Zatem według kwantowej teorii pola, cząstki są wzbudzeniami pól kwantowych, które wypełniają całą przestrzeń, oczywiście także w atomie.
W miarę jak fizycy odkrywali coraz więcej cząstek i związanych z nimi pól, rozwijała się inna perspektywa. Okazywało się, że właściwości tych cząstek i pól odpowiadają liczbowym wzorom. Rozszerzając te wzory, fizycy mogli przewidzieć istnienie kolejnych cząstek. Wzory sugerowały również bardziej abstrakcyjne i potencjalnie głębsze spojrzenie na to, czym tak naprawdę są cząstki.
Dotarliśmy do wyższego stopnia wtajemniczenia. Na tym poziomie cząstka elementarna to "nieredukowalna reprezentacja grupy Poincarégo". Cząstki w tym rozumieniu to "reprezentacje" "grup symetrii", czyli zbiorów przekształceń, które można wykonać na obiektach matematycznych (9). Weźmy, na przykład, trójkąt równoboczny. Gdy obracamy go o 120 lub 240 stopni, lub nie robimy z nim nic, trójkąt wygląda tak samo jak poprzednio. Wszystkie te symetrie tworzy grupę. Grupa ta może być wyrażona jako zbiór matematycznych macierzy - tablic liczb, które po pomnożeniu przez współrzędne trójkąta równobocznego zwracają te same współrzędne. Taki zbiór macierzy jest "reprezentacją" grupy symetrii.
Podobnie elektrony, fotony i inne fundamentalne cząstki to obiekty będące reprezentacjami grupy Poincarégo. To grupa odzwierciedlająca dziesięć sposobów poruszania się w czasoprzestrzeni. Obiekty mogą przesuwać się w trzech kierunkach przestrzennych lub przesuwać się w czasie, mogą również obracać się w trzech kierunkach lub otrzymać impuls w dowolnym z tych kierunków. Jako najprostsze możliwe obiekty, które mogą być przesuwane, obracane i wzmacniane zidentyfikował cząstki w 1939 roku fizyk Eugene Wigner. Zdał sobie sprawę, że aby obiekt mógł się ładnie przekształcać zgodnie z tymi dziesięcioma przekształceniami Poincarégo, musi mieć pewien minimalny zestaw właściwości, a cząstki mają te właściwości. Jedną z nich jest energia, która pozostaje taka sama, gdy obiekt przesuwa się w czasie.
Moment to własność, która pozostaje taka sama, gdy obiekt porusza się w przestrzeni. Potrzebna jest trzecia właściwość, aby określić, jak cząstki zmieniają się pod wpływem kombinacji przestrzennych obrotów i przyspieszeń (które łącznie są obrotami czasoprzestrzeni). Tą kluczową własnością jest spin. W czasach Wignera fizycy wiedzieli już, że cząstki mają spin, rodzaj wewnętrznego momentu pędu, który determinuje wiele aspektów zachowania cząstek, w tym to, czy zachowują się one jak materia (jak elektrony), czy jak oddziaływanie (jak fotony).
Różne reprezentacje grupy Poincarégo to cząstki z różną liczbą etykiet spinowych, czyli stopni swobody, na które wpływają obroty. Istnieją na przykład cząstki z trzema spinowymi stopniami swobody. Cząstki te obracają się w taki sam sposób, jak znane nam obiekty trójwymiarowe. Natomiast wszystkie cząstki materii mają dwa stopnie swobody, nazywane "spin-up" i "spin-down", które obracają się inaczej. W przyrodzie pojawiają się też cząstki elementarne z jedną i pięcioma etykietami spinowymi.
Wydaje się, że brakuje jedynie reprezentacji grupy Poincarégo z czterema etykietami spinowymi.
Zgodność pomiędzy cząstkami elementarnymi a reprezentacjami jest tak zgrabna, że niektórzy fizycy zrównują je ze sobą. Inni uważają to za pomieszanie pojęć. "Reprezentacja nie jest cząstką; reprezentacja jest sposobem opisania pewnych właściwości cząstki", twierdzi Sheldon Glashow, laureat Nagrody Nobla, teoretyk cząstek elementarnych.
Cząstki o tej samej energii, pędzie i spinie zachowują się identycznie w dziesięciu transformacjach Poincarégo, ale mogą się różnić na inne sposoby. Na przykład, mogą nieść różne ilości ładunku elektrycznego.
Gdy w połowie XX wieku odkryto całe cząsteczkowe zoo, ujawniły się dodatkowe różnice między cząstkami, wymagające nowych oznaczeń, zwanych "kolorem" i "smakiem". Teoretycy zrozumieli, że ich dodatkowe właściwości odzwierciedlają dodatkowe sposoby, w jakie można przekształcać cząstki. Ale zamiast przesuwać obiekty w czasoprzestrzeni, te nowe transformacje są bardziej abstrakcyjne; zmieniają one "wewnętrzne" stany cząstek, choć to niezbyt precyzyjne sformułowanie.
Weźmy na przykład właściwość znaną jako kolor: w latach 60. fizycy ustalili, że kwarki, elementarne składniki jąder atomowych, istnieją w przypadkowej kombinacji trzech możliwych stanów, czyli opisywanych wyżej "kolorów". Kwarki, ze swoimi trzema etykietami, są reprezentacjami grupy przekształceń zwanej SU(3), zwanej też grupą cechowania oddziaływań silnych, na którą składają się sposoby matematycznego mieszania tych trzech etykiet. Cząstki mające wewnętrzne własności smaku i ładunku elektrycznego są reprezentacjami grupy cechowania oddziaływań elektrosłabych SU(2) i grupy cechowania oddziaływań elektromagnetycznych U(1).
Tak więc Model Standardowy fizyki cząstek elementarnych jest często określany jako reprezentacja grupy symetrii SU(3) × SU(2) × U(1), składającej się ze wszystkich kombinacji operacji symetrii w trzech podgrupach. W latach 70. Sheldon Lee Glashow, Dimitri Nanopoulos i inni próbowali dopasować i zawrzeć symetrie SU(3), SU(2) i U(1) w pojedynczej, większej grupie przekształceń, w oparciu na założeniu, że cząstki były reprezentacjami pojedynczej grupy symetrii na początku Wszechświata. Najbardziej naturalnym kandydatem do tego rodzaju unifikującej teorii była grupa symetrii zwana SU(5), ale eksperymenty szybko wykluczyły tę opcję.
Idea strun czy też superstrun zakłada, że jeśli udałoby się wejrzeć dostatecznie głęboko w cząstki, to ujrzymy nie punkty, ale jednowymiarowe drgające struny. W każdym punkcie czasoprzestrzeni zwiniętych ma być sześć dodatkowych wymiarów przestrzennych. Geometria tych dodatkowych wymiarów determinuje właściwości strun, a tym samym świata makroskopowego. "Wewnętrzne" symetrie cząstek jak operacje SU(3), które przekształcają kolor kwarków, nabierają fizycznego znaczenia.
W 2010 r. Mark Van Raamsdonk, członek zespołu naukowego występującego pod nazwą "It from Qubit", napisał znany w środowisku naukowym esej, w którym odważnie ogłosił to, co sugerowały różne obliczenia. Twierdził, że tkaniną spajającą czasoprzestrzeń mogą być splątane kubity. Zgodnie z nią, właściwości czasoprzestrzeni, jej trwałość, stałość, symetrie, zasadniczo są podobnego do kodowania binarnego "0" i "1". Długotrwałe poszukiwania kwantowego opisu grawitacji stają się w tej koncepcji kwestią zidentyfikowania wzoru splątania kubitów, który koduje szczególny rodzaj czasoprzestrzennej tkaniny występującej w rzeczywistym Wszechświecie.
Co ważne, operacje algebraiczne na kubitach, po przetłumaczeniu ich na czasoprzestrzeń, "zachowują się tak samo jak fizyczne odziaływania na cząstki", twierdzi Van Raamsdonk. "Zdajesz sobie sprawę, że ten niegrawitacyjny system kwantowy koduje pewien obraz. I coś w tym kodzie, jeśli możesz go rozszyfrować, mówi ci, że są cząstki innej przestrzeni, w której odczuwasz grawitację". Tak, oczywiście to nic innego jak hipoteza holograficzna. Jeśli obraz "It from Qubit" jest poprawny, to cząstki są hologramami, tak jak czasoprzestrzeń, zaś ich najwłaściwszą definicją jest definicja w kategoriach kubitów.
Dziwne atomy i ich ekscentryczne zwyczaje
Ostatnie lata w fizyce to seria odkryć i wyników eksperymentów zapowiadających kolejne zmiany w teoriach, definicjach i w wyobrażeniach na temat atomu. Wygląda na to, że model, który wydawał się "poukładany", znów trzeba będzie układać na nowo, choć to zapewne jeszcze trochę potrwa.
W 2002 r. zespół naukowców z amerykańskiego Uniwersytetu Purdue przewidział, że tzw. atomy Rydberga mogą przyciągać i wiązać się z innymi atomami. W tamtym czasie uważano to za niemożliwe z punktu widzenia obowiązującej teorii wiązań atomowych. Tę hipotetyczną kombinację nazwali motylkową cząsteczką Rydberga, ze względu na przypominające motyla rozmieszczenie elektronów na orbitach. 14 lat później ten sam zespół w końcu zaobserwował w laboratorium cząsteczkę motylkową Rydberga, a przy okazji odkrył zupełnie nowy rodzaj słabego wiązania atomowego. "Ten nowy mechanizm wiązania, w którym elektron może złapać i uwięzić atom, to całkowita nowość z punktu widzenia chemii", wyjaśniał w publikacji, która ukazała się w "Nature Communications", Chris Greene, szef zespołu. "To zupełnie nowy sposób, w jaki atom może być związany z innym atomem".
Zespół schłodził gazowy rubid do temperatury stu nanokelwinów, jednej dziesięciomilionowej stopnia powyżej zera absolutnego, a następnie wzbudził atomy do stanu Rydberga za pomocą laserów. Naukowcy odkryli, że odległe od jąder atomowych elektrony rzeczywiście mogą pomóc w przyciąganiu i wiązaniu się z innymi atomami, tak jak przewidzieli to w 2002 roku. "Ten daleki elektron jest jak pies pasterski", wyjaśnia Greene. "Za każdym razem, gdy zbliża się do innego atomu, atomu Rydberga dodaje trochę siły przyciągania i popycha go w kierunku jednego miejsca, aż do momentu, gdy przechwyci i zwiąże ze sobą dwa atomy". Motylowate cząsteczki Rydberga są znacznie większe niż zwykłe cząsteczki chemiczne ze względu na elektrony krążące na odległych orbitach. Odkrycia te mogą mieć też praktyczny wymiar. Można to wykorzystać w rozwoju elektroniki i tworzenia maszyn w skali molekularnej, ponieważ wymagają mniej energii manipulacji.
W 2018 również z wykorzystaniem atomów Rydberga powstały na Uniwersytecie Rice w Teksasie "gigantyczne atomy", wypełnione zwykłymi atomami. W tym projekcie badawczym połączono dwie dziedziny fizyki atomowej, które można badać tylko w warunkach ekstremalnych - kondensaty Bosego-Einsteina i atomy Rydberga.
Kondensat Bose-Einstein jest stanem materii wytwarzanym przez atomy w temperaturach bliskich zera absolutnego. Atomy Rydberga to te, w których jeden pojedynczy elektron jest podnoszony do bardzo wzbudzonego stanu, przez co przebywa w bardzo dużej odległości od jądra. "Średnia odległość pomiędzy elektronem a jego jądrem może wynosić kilkaset nanometrów, czyli ponad tysiąc razy więcej niż promień atomu wodoru", wyjaśnia w pracy opublikowanej w "Physical Review Letters" prof. Joachim Burgdörfer z Uniwersytetu Wiedeńskiego, który należał do zespołu.
W zależności od promienia atomu Rydberga i gęstości kondensatu Bosego-Einsteina, wewnątrz tak ogromnej orbity elektronu pomieścić się może nawet do 170 dodatkowych atomów strontu. Jak pokazują symulacje komputerowe, stosunkowo słaby rodzaj interakcji zmniejsza całkowitą energię systemu i powstaje połączenie pomiędzy atomem Rydberga a innymi atomami w obrębie "orbity" elektronowej. Wiązanie to jest znacznie słabsze od wiązania między atomami w kryształach. Dlatego ów egzotyczny stan materii, nazywany polaronami Rydberga, daje się wykryć jedynie w bardzo niskich temperaturach.
Jak się też okazuje, niektóre atomy (a raczej atomy w specyficznych stanach) mogą tworzyć rzeczywiste wiązania z… "niczym". Znów mowa o atomach Rydberga, których kolejne dziwne zachowania opisano we wrześniu w czasopiśmie "Physical Review Letters". Okazuje się, że naukowcy mogli "oszukać" odległy od jądra elektron, by "myślał", że wiąże się z innym atomem, choć w rzeczywistości tego atomu nie było. Oczywiście, takie rzeczy tylko w świecie kwantowym, choć samo odkrycie może mieć ciekawe konsekwencje.
Dziwne zjawiska zachodzące w atomach Rydberga, to oczywiście tylko jeden z wielu sygnałów, że czas po raz kolejny porzucić utarte, choć wcale nie tak stare, wyobrażenia o atomie. Jeśli jednak pragniemy tworzyć technikę opartą na procesach na poziomie atomu, a współcześnie mówi się o tym bardzo dużo, wypadałoby się o tym świecie dowiedzieć znacznie więcej, niż wiedzieliśmy dotychczas.
Mirosław Usidus