Te, które tworzą sole, część 4 Brom

Przykładowo, brom to jedyna ciecz wśród niemetali, a i jego barwa pozostaje unikatowa w świecie pierwiastków. Najważniejsze jednak, że w domu można z nim wykonać interesujące doświadczenia.
- Coś tu brzydko pachnie! -
… …zawołał francuski chemik Joseph Gay-Lussac, gdy latem 1826 r. na polecenie Akademii Francuskiej sprawdzał doniesienie o odkryciu nowego pierwiastka. Jego autorem był szerzej nieznany Antoine Balard. Ten 23-letni aptekarz rok wcześniej badał możliwości otrzymywania jodu z ługów warzelniczych pozostających po wykrystalizowaniu soli kamiennej z wody morskiej (tą metodą otrzymuje się sól w rejonach o ciepłym klimacie, np. na francuskim wybrzeżu Morza Śródziemnego). Przez roztwór przepuszczał chlor, który wypierał jod z jego soli. Otrzymał ten pierwiastek, ale zauważył coś jeszcze - warstewkę żółtawej cieczy o silnej woni. Wydzielił ją, a następnie osuszył. Pozostałość okazała się ciemnobrunatną cieczą, nieprzypominającą żadnej znanej substancji. Wyniki prób wykonanych przez Balarda sugerowały, że jest to nowy pierwiastek. Wysłał więc stosowne doniesienie do Akademii Francuskiej i czekał na jej werdykt. Po potwierdzeniu odkrycia Balarda, dla pierwiastka zaproponowano nazwę brom, pochodzącą od greckiego bromos, czyli fetor, bo rzeczywiście zapach bromu nie należy do przyjemnych (1).
Uwaga! Przykra woń to nie jedyna wada bromu. Pierwiastek ten jest równie szkodliwy, jak wyżej położone fluorowce, a po kapnięciu na skórę pozostawia trudno gojące się rany. Dlatego pod żadnym pozorem nie otrzymuj bromu w czystej postaci i unikaj wdychania zapachu jego roztworu.
Pierwiastek z morskiej wody
Woda morska zawiera prawie cały brom obecny na kuli ziemskiej. Działanie na nią chloru powoduje wydzielenie bromu ulatniającego się wraz z powietrzem, którym przedmuchuje się wodę. W odbieralniku brom skrapla się, a następnie jest oczyszczany przez destylację. Ze względu na konkurencję tańszego chloru i mniejszą reaktywność, brom jest używany tylko wtedy, gdy to niezbędne. Wiele z zastosowań odeszło już do historii, np. bromku srebra w fotografii, dodatków do benzyn ołowiowych czy halonowych środków gaśniczych. Brom jest składnikiem baterii cynkowo-bromowych, a jego związki wykorzystuje się jako leki, barwniki, dodatki zmniejszające palność tworzyw sztucznych i środki ochrony roślin.
Pod względem chemicznym brom nie odbiega od innych chlorowców: tworzy mocny kwas bromowodorowy HBr, sole z anionem Br- oraz kilka kwasów tlenowych i pochodzące od nich sole.
Analityka bromu
Reakcje charakterystyczne dla anionu bromkowego są podobne do prób wykonanych dla chlorków. Po dodaniu roztworu azotanu(V) srebra AgNO3 wytrąci się trudno rozpuszczalny osad AgBr, ciemniejący na świetle z powodu rozkładu fotochemicznego. Osad ma barwę żółtawą (w przeciwieństwie do białego AgCl i żółtego AgI) oraz słabo rozpuszcza się po dodaniu roztworu amoniaku NH3aq (co odróżnia go od dobrze rozpuszczalnego w tych warunkach AgCl) (2).
Najprościej wykryć bromki przez ich utlenienie i stwierdzenie obecności wolnego bromu. Do próby potrzebne będą: bromek potasu KBr, nadmanganian potasu KMnO4, roztwór kwasu siarkowego(VI) H2SO4 oraz rozpuszczalnik organiczny (np. rozcieńczalnik do farb). Do probówki wlej niewielkie ilości roztworów KBr oraz KMnO4, a następnie kilka kropli kwasu. Zawartość natychmiast zmienia barwę na żółtawą (początkowo była fioletowa od dodanego nadmanganianu):
2KMnO4 +10KBr +8H2SO4 →2MnSO4 +6K2SO4 +5Br2 +8H2O Dodaj porcję
rozpuszczalnika i wstrząśnij probówką tak, aby zmieszać zawartość. Po rozwarstwieniu zobaczysz, że warstwa organiczna zabarwiła się na brunatno-czerwono. Brom lepiej rozpuszcza się w cieczach niepolarnych i przeszedł z wody do rozpuszczalnika. Obserwowane zjawisko to ekstrakcja (3).
Woda bromowa własnego wyrobu
Woda bromowa to wodny roztwór, przemysłowo otrzymywany przez rozpuszczenie bromu w wodzie (ok. 3,6 g bromu w 100 g wody). Jest to odczynnik stosowany jako łagodny utleniacz oraz do wykrywania nienasyconego charakteru związków organicznych. Jednak wolny brom to niebezpieczna substancja, a ponadto woda bromowa nie jest trwała (brom paruje z roztworu i reaguje z wodą). Dlatego najlepiej otrzymać ją nieco okrężną drogą i od razu zużyć do doświadczeń.
Pierwszą metodę już poznałeś podczas wykrywania bromków: utlenianie prowadzące do powstania wolnego bromu. Tym razem do roztworu bromku potasu KBr znajdującego się w kolbie dodaj kilka kropli H2SO4 i porcję wody utlenionej (3% roztwór H2O2 stosowany jako środek dezynfekcyjny). Mieszanina po chwili przybiera żółtawe zabarwienie:
2KBr +H2O2 +H2SO4 →K2SO4 +Br2 +2H2O
Tak otrzymana woda bromowa jest zanieczyszczona, ale przeszkadza tylko H2O2. Należy go zatem usunąć przy pomocy dwutlenku manganu MnO2, który rozłoży nadmiar nadtlenku wodoru. Związek najłatwiej otrzymasz z jednorazowych ogniw (z oznaczeniem typu R03, R06), gdzie znajduje się w postaci ciemnej masy wypełniającej cynkowy kubeczek. Wrzuć szczyptę masy do kolby, a po reakcji zlej ciecz znad osadu i masz gotowy odczynnik.
Inną metodą jest elektroliza wodnego roztworu KBr. Aby otrzymać w miarę czysty roztwór bromu, musisz zbudować elektrolizer przeponowy, czyli po prostu przedzielić zlewkę dopasowanym kawałkiem tektury (w ten sposób ograniczysz mieszanie się produktów reakcji na elektrodach). Jako elektroda dodatnia posłuży grafitowa pałeczka wyjęta z ogniwa 3 jednorazowego oznaczonego jak wyżej, a w roli ujemnej użyj zwykłego gwoździa. Źródłem prądu jest płaska bateria o napięciu 4,5 V. Do zlewki wlej roztwór KBr, włóż elektrody z przymocowanymi przewodami i podłącz baterię do kabelków. W pobliżu elektrody dodatniej roztwór zabarwi się na żółtawy kolor (to twoja woda bromowa), natomiast na ujemnej wydzielają się pęcherzyki wodoru (4). Nad zlewką wyczuwalny jest ostry zapach bromu. Roztwór pobieraj przy pomocy strzykawki lub pipety.
Wodę bromową możesz przechować przez krótki czas w szczelnie zamkniętym naczyniu, bez dostępu światła i w chłodnym miejscu - najlepiej jednak wypróbuj ją od razu. Jeśli wykonałeś papierki jodoskrobiowe wg przepisu z drugiego odcinka cyklu, na papierek nanieś kroplę wody bromowej. Natychmiast pojawi się ciemna plama sygnalizującą utworzenie wolnego jodu:
2KI + Br2 → I2 + KBr
Tak jak brom otrzymuje się z wody morskiej przez wypieranie go z bromków przez silniejszy utleniacz (chlor), tak też brom wypiera słabszy od niego jod z jodków (oczywiście chlor również wyprze jod).
Jeżeli nie dysponujesz papierkiem jodoskrobiowym, do probówki wlej roztwór jodku potasu i dodaj kilka kropli wody bromowej. Roztwór ciemnieje, a gdy dodasz wskaźnik skrobiowy (zawiesina mąki ziemniaczanej w wodzie), staje się granatowy - wynik wskazuje na pojawienie się wolnego jodu (5).
Dwa kuchenne eksperymenty
Spośród wielu doświadczeń z wodą bromową proponuję dwa, do których potrzebne będą odczynniki znajdujące się w kuchni. W pierwszym z nich sięgnij po butelkę oleju rzepakowego,
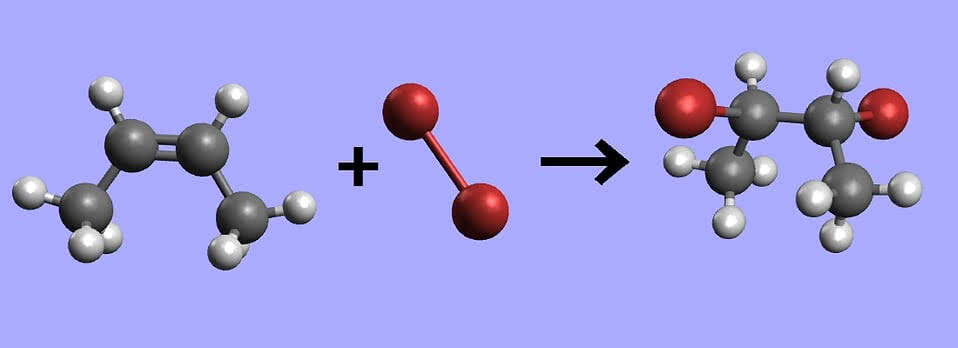
słonecznikowego lub oliwy z oliwek. Do probówki z wodą bromową wlej niewielką ilość oleju roślinnego i wstrząśnij zawartością w celu dobrego zmieszania reagentów. Gdy nietrwała emulsja ulegnie rozwarstwieniu, olej znajdzie się na górze (ma mniejszą gęstość niż woda), natomiast woda bromowa na dole. Jednak warstwa wodna utraciła żółtawą barwę. To efekt "zabrania" bromu z roztworu wodnego i zużycia go do reakcji ze składnikami oleju (6).
Olej roślinny zawiera dość dużo nienasyconych kwasów tłuszczowych (połączonych z gliceryną w tłuszcze). Do wiązań podwójnych w cząsteczkach tych kwasów przyłączają się atomy bromu, tworząc odpowiednie bromopochodne. Odbarwienie wody bromowej to znak, że w badanej próbce znajdują się nienasycone związki organiczne, czyli mające wiązania podwójne lub potrójne pomiędzy atomami węgla (7).
Do drugiego kuchennego eksperymentu przygotuj spożywczą sodę oczyszczoną, czyli wodorowęglan sodu NaHCO3, oraz dwa cukry - glukozę i fruktozę. Sodę i glukozę nabędziesz w sklepie spożywczym, a fruktozy szukaj na stoisku z produktami dla diabetyków lub w sklepie ze zdrową żywnością. Glukoza i fruktoza tworzą sacharozę, czyli zwykły cukier. Dodatkowo są do siebie bardzo podobne pod względem właściwości i mają taki sam wzór sumaryczny, a jakby tego było mało - łatwo przechodzą jedna w drugą. Co prawda są między nimi różnice: fruktoza jest słodsza od glukozy, a w roztworze skręca płaszczyznę światła spolaryzowanego w innym kierunku. Do identyfikacji wykorzystasz jednak odmienność w budowie chemicznej: glukoza jest aldehydem, a fruktoza - ketonem.
Pamiętasz może, że cukry redukujące identyfikuje się przy pomocy prób Trommera i Tollensa. Pojawienie się ceglastego osadu Cu2O (w pierwszej próbie) lub lustra srebrowego (w drugiej) świadczy o obecności związków o charakterze redukującym, np. aldehydów.
Jednak te próby nie zapewniają odróżnienia aldehydu glukozy od ketonu fruktozy, ponieważ w środowisku reakcji fruktoza szybko zmieni strukturę, przekształcając się w glukozę. Potrzebny jest subtelniejszy odczynnik.
Halogeny na niby
Tu do gry wchodzi woda bromowa. Sporządź roztwory: glukozy z dodatkiem NaHCO3 oraz fruktozy również z dodatkiem sody oczyszczonej. Do jednej probówki zawierającej wodę bromową wlej przygotowany roztwór glukozy, a do drugiej, również z wodą bromową - roztwór fruktozy. Różnica jest wyraźnie widoczna: woda bromowa odbarwiła się pod wpływem roztworu glukozy, natomiast fruktoza nie spowodowała żadnej zmiany. Rozróżnienie obu cukrów jest możliwe tylko w środowisku słabo zasadowym (które zapewnia wodorowęglan sodu) oraz przy działaniu łagodnego utleniacza, czyli wody bromowej. Użycie mocno zasadowego roztworu (niezbędnego do wykonania prób Trommera i Tollensa) powoduje szybkie przejście jednego cukru w drugi i odbarwienie wody bromowej także przez fruktozę. Jeśli chcesz się o tym przekonać, powtórz próbę, używając wodorotlenku sodu zamiast sody oczyszczonej.