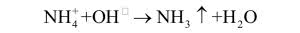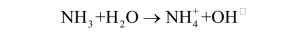Wzorzec metaliczności, część 3 - cała reszta

Trzy ostatnie pierwiastki są do siebie bardzo podobne, a zarazem zbliżone właściwościami do potasu i wraz z nim tworzą podgrupę zwaną potasowcami. Ponieważ prawie na pewno nie będziesz w stanie wykonać żadnego eksperymentu z rubidem i cezem, musi zatem wystarczyć ci informacja, że reagują one, tak jak potas, a ich związki mają podobną rozpuszczalność do jego połączeń.
Pierwszy sukces spektroskopii
Zjawisko barwienia płomienia przez związki niektórych pierwiastków znano i stosowano do wyrobu ogni sztucznych na długo przed ich wydzieleniem w stanie wolnym. W początkach XIX wieku uczeni badali linie widmowe występujące w świetle Słońca oraz wysyłane przez rozgrzane związki chemiczne. W roku 1859 dwaj niemieccy fizycy - Robert Bunsen i Gustav Kirchhoff - zbudowali przyrząd do badania emitowanego światła (1). Pierwszy spektroskop był prostą konstrukcją: składał się z pryzmatu rozszczepiającego światło na linie widmowe i okularu z soczewką do ich obserwacji (2). Od razu zauważono przydatność spektroskopu do analizy chemicznej: substancja w wysokiej temperaturze płomienia rozpada się na atomy, a te emitują linie charakterystyczne tylko dla siebie.
Bunsen i Kirchoff przystąpili do badań i rok później odparowali aż 44 tony wody mineralnej ze źródła w Dürkheim. W widmie osadu pojawiły się linie, których nie można było przypisać żadnemu ówcześnie znanemu pierwiastkowi. Bunsen (był również chemikiem) wydzielił z osadu chlorek nowego pierwiastka, a zawartemu w nim metalowi nadał nazwę cez pochodzącą od silnych niebieskich linii w jego widmie (łac. caesium = niebieski) (3).
Po kilku miesiącach, już w roku 1861, uczeni dokładniej przebadali widmo osadu solnego i stwierdzili w nim obecność linii jeszcze jednego pierwiastka. Udało im się wydzielić jego chlorek i oznaczyć masę atomową. Ponieważ w widmie wyraźnie prezentowały się czerwone linie, nowy litowiec otrzymał nazwę rubid (z łac. rubidus = ciemnoczerwony) (4). Odkrycie dwóch pierwiastków metodą analizy widmowej przekonało do niej chemików i fizyków. W kolejnych latach spektroskopia stała się jednym z podstawowych narzędzi badawczych, a odkrycia posypały się jak z rogu obfitości.
Rubid nie tworzy własnych minerałów, a cez tylko jeden (5). Oba pierwiastki stanowią domieszkę w minerałach innych litowców. Powierzchniowa warstwa Ziemi zawiera 0,029% rubidu (co daje mu 17 miejsce na liście rozpowszechnienia pierwiastków) i 0,0007% cezu (39 miejsce). Nie są one biopierwiastkami, ale niektóre rośliny wybiórczo magazynują rubid, np. tytoń i buraki cukrowe. Po względem fizykochemicznym oba metale to "potas na sterydach": jeszcze bardziej miękkie i łatwo topliwe i jeszcze bardziej reaktywne (np. samorzutnie zapalają się na powietrzu, a z wodą reagują wręcz wybuchowo).
Cez to w ogóle najbardziej "metaliczny" pierwiastek (w chemicznym, nie potocznym, znaczeniu tego słowa). Jak wspomniano wyżej, również właściwości tworzonych przez nie związków są podobne do analogicznych połączeń potasu.
Metaliczny rubid i cez otrzymuje się przez redukcję ich związków magnezem lub wapniem w próżni. Ponieważ potrzebne są właściwie tylko do wytwarzania niektórych typów fotokomórek (padające światło powoduje łatwą emisję elektronów z ich powierzchni), roczna produkcja rubidu i cezu jest rzędu setek kilogramów. Również ich związki nie znajdują wielu zastosowań.
Podobnie jak w przypadku potasu, jeden z izotopów rubidu jest promieniotwórczy. Rb-87 ma okres połowicznego rozpadu wynoszący 50 miliardów lat, zatem emisja promieniowania jest bardzo słaba. Izotop ten jest wykorzystywany do datowania skał. Cez nie ma naturalnych izotopów promieniotwórczych, ale Cs-137 to jeden z produktów rozszczepienia uranu w reaktorach jądrowych. Wyodrębnia się go ze zużytych prętów paliwowych, ponieważ izotop znalazł zastosowanie jako źródło promieniowania g, np. do niszczenia guzów nowotworowych.
Na cześć Francji
Istnienie litowca cięższego od cezu przewidział już Mendelejew i nadał mu roboczą nazwę eka-cez. Chemicy podjęli jego poszukiwania w minerałach innych litowców, ponieważ - jako ich kuzyn - tam właśnie powinien się znajdować. Kilka razy wydawało się, że został wykryty, jednak hipotetyczne russium, alcalinum, virginium i moldavium nigdy się nie zmaterializowały.
W początkach XX wieku zdawano sobie sprawę, że pierwiastek 87 jest promieniotwórczy. W roku 1914 bliscy odkrycia byli austriaccy fizycy. S. Meyer, V. Hess i F. Paneth zaobserwowali słabą emisję cząstek alfa z preparatu aktynu-227 (oprócz obficie wydzielanych cząstek beta). Ponieważ liczba atomowa aktynu wynosi 89, a emisja cząstki alfa wiąże się z "cofnięciem" pierwiastka o dwa miejsca w układzie okresowym, musiał powstawać izotop o liczbie atomowej 87 i masowej 223. Jednak cząstki alfa o podobnej energii (mierzy się zasięg cząstek w powietrzu proporcjonalny do ich energii) wysyła również izotop protaktynu, inni uczeni sugerowali zanieczyszczenie preparatu.
Wkrótce wybuchła wojna i zapomniano o całej sprawie. W latach 30-tych skonstruowano akceleratory cząstek i wytworzono pierwsze sztuczne pierwiastki, np. od równie dawna poszukiwany astat o liczbie atomowej 85. W przypadku pierwiastka 87 poziom ówczesnej techniki nie pozwalał na uzyskanie odpowiedniej ilości materiału do syntezy. Niespodziewanie sukces odniosła francuska fizyczka Marguerite Perey, uczennica Marii Skłodowskiej-Curie (6). Ona również, jak Austriacy ćwierć wieku wcześniej, badała rozpad aktynu-227. Postęp techniczny pozwolił na uzyskanie czystego preparatu i tym razem nikt już nie miał wątpliwości, że wreszcie zidentyfikowano eka-cez. Odkrywczyni nadała mu nazwę frans na cześć swojej ojczyzny. Pierwiastek 87 było ostatnim odkrytym w minerałach, kolejne otrzymywano już sztucznie.
Frans powstaje w bocznej odnodze szeregu promieniotwórczego, w procesie o niewielkiej wydajności i w dodatku jest bardzo krótko żyjący. Najtrwalszy jest izotop odkryty przez panią Perey – Fr-223 z okresem połowicznego rozpadu nieznacznie przekraczającym 20 minut (co oznacza, że po godzinie zostanie go zaledwie 1/8 początkowej ilości). Oszacowano, że na całej kuli ziemskiej znajduje się tylko około 30 gramów fransu (ustala się równowaga pomiędzy izotopem rozpadającym się i nowo tworzonym).
Mimo, że nie otrzymano widzialnej porcji związków fransu, zbadano jego właściwości i stwierdzono przynależność do grupy litowców. Dla przykładu: gdy do roztworu zawierającego jony fransu oraz potasu doda się nadchloranów, to promieniotwórczy będzie osad, a nie roztwór. Takie zachowanie świadczy, że FrClO4 jest słabo rozpuszczalny (wytrąca się razem z KClO4), a własności fransu są podobne do potasu.
…gdyby udało się otrzymać jego próbkę widoczną gołym okiem? Na pewno miękki jak wosk i prawdopodobnie ze złocistym odcieniem (leżący powyżej w układzie okresowym cez jest bardzo miękki i ma żółtawą barwę). Topiłby się w temperaturze 20-25°C, natomiast w pobliżu temperatury 650°C przechodziłby w stan pary (oszacowanie na podstawie danych z poprzedniego odcinka). Do tego byłby bardzo aktywny chemicznie. Należałoby go więc przechowywać bez dostępu tlenu i wilgoci, a do tego w pojemniku chroniącym przed promieniowaniem. Z wykonaniem doświadczeń należałoby się bardzo spieszyć, ponieważ po kilku godzinach praktycznie nie byłoby już fransu.
Honorowy litowiec
Pamiętasz pseudohalogeny z ubiegłorocznego cyklu o fluorowcach? To jony, które zachowaniem przypominają aniony takie jak Cl– czy Br–. Należą do nich na przykład cyjanki CN– i rodanki SCN–, tworzące sole o podobnej rozpuszczalności jak w przypadku anionów grupy 17.
Litowce również mają swojego naśladowcę, a jest nim jon amonowy NH 4 + – produkt rozpuszczenia amoniaku w wodzie (roztwór ma odczyn zasadowy, choć słabszy niż w przypadku wodorotlenków litowców) oraz jego reakcji z kwasami. Jon reaguje podobnie do cięższych litowców, a najbliższe pokrewieństwo łączy go z potasem, np. ma rozmiary zbliżone do kationu potasowego i często zastępuje K+ w jego naturalnych związkach. Litowce są zbyt reaktywne, aby można je było otrzymać na drodze elektrolizy wodnych roztworów soli i wodorotlenków. Użycie elektrody rtęciowej pozwala uzyskać roztwór metalu w rtęci (amalgamat). Jon amonowy tak bardzo upodabnia się do litowców, że i on tworzy amalgamat.
W systematycznym przebiegu analizy litowce wraz jonem magnezu wykrywane są na samym końcu. Powodem jest fakt dobrej rozpuszczalności ich chlorków, siarczanów i siarczków, co sprawia, że nie wytrącają się one pod wpływem wcześniej dodawanych odczynników użytych do stwierdzeniu obecności cięższych metali w próbce. Chociaż sole amonowe są również dobrze rozpuszczalne, wykrywa się je na samym początku analizy, ponieważ nie przetrwają operacji ogrzewania i odparowywania roztworów (dość łatwo ulegają rozkładowi z wydzieleniem amoniaku). Procedura jest zapewne znana każdemu: do próbki dodaje się roztworu mocnej zasady (NaOH czy KOH), co powoduje wydzielanie amoniaku.
Sam amoniak wykrywany jest po zapachu lub przez umieszczenie u wylotu probówki zwilżonego wodą papierka uniwersalnego. Gazowy NH3 rozpuszcza się w wodzie i zmienia odczyn roztworu na zasadowy, a kolor papierka na niebieski.
Podczas wykrywaniu amoniaku przy pomocy zapachu pamiętaj o zasadach użycia nosa w laboratorium. Nie pochylaj się więc nad naczyniem reakcyjnym, opary kieruj wachlującym ruchem dłoni w swoją stronę i nie zaczerpuj powietrza "pełną piersią", lecz pozwól, aby woń związku sama dotarła do nosa.
Rozpuszczalność soli amonowych jest podobna do analogicznych związków potasu, możesz więc pokusić się o otrzymanie osadów nadchloranu amonu NH4ClO4 oraz kompleksowego połączenia z kobaltem (po szczegóły odsyłam do poprzedniego odcinka). Przedstawione sposoby nie nadają się jednak do wykrywania bardzo małych ilości amoniaku i jonów amonowych w próbce. W laboratoriach stosuje się do tego celu odczynnik Nesslera, dający osad lub zmieniający barwę nawet w obecności śladów NH3 (7).
Stanowczo odradzam ci jednak wykonanie odpowiedniej próby w domu, ponieważ zachodzi konieczność stosowania trujących związków rtęci.
Poczekaj, aż znajdziesz się w profesjonalnym laboratorium pod fachowym okiem opiekuna. Chemia jest pasjonująca, ale - dla nie znających jej lub nieostrożnych - bywa groźna.
Krzysztof Orliński